
【题目】常温下将NaOH溶液滴入二元弱酸H2X溶液中,混合溶液中的离子浓度与溶液pH的变化关系如图所示。下列叙述正确的是

A. Kal(H2X)的数量级为10-7
B. 曲线N表示lg 与pH的变化关系
与pH的变化关系
C. NaHX溶液中:c(H+)<c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(X2-)>c(HX-)> c(H+)=c(OH-)
【答案】D
【解析】A、发生的反应先后顺序是H2X+NaOH=NaHX+H2O、NaHX+NaOH=Na2X+H2O,开始随着反应的进行,HX-物质的量增多,某一时刻当HX-的物质的量大于H2X,其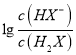 数值先大于0,根据图像,因此M为
数值先大于0,根据图像,因此M为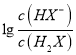 ,N为
,N为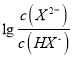 ,H2X的第一电离:H2X
,H2X的第一电离:H2X![]() HX-+H+,Ka1=
HX-+H+,Ka1=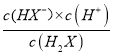 ,根据具图像,每一小格代表0.2,即找出(5 0.6)点,代入数值,解得Ka1=10-5,故A错误;B、根据选项A的分析,故B错误;C、当H2X全部转化成NaHX,继续加入NaOH溶液,发生NaHX+NaOH=Na2X+H2O,随着氢氧化钠量的增加,X2-增加,当X2-的物质的量大于HX-时,
,根据具图像,每一小格代表0.2,即找出(5 0.6)点,代入数值,解得Ka1=10-5,故A错误;B、根据选项A的分析,故B错误;C、当H2X全部转化成NaHX,继续加入NaOH溶液,发生NaHX+NaOH=Na2X+H2O,随着氢氧化钠量的增加,X2-增加,当X2-的物质的量大于HX-时, 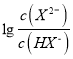 >0,根据图像,此时的溶液显酸性,说明NaHX的溶液中HX-的电离程度大于其水解,溶液显酸性,即c(H+)>c(OH-),故C错误;D、NaHX的水溶液显酸性,因此溶液显中性时,溶质为NaHX和Na2X,HX-的电离平衡常数Ka2=
>0,根据图像,此时的溶液显酸性,说明NaHX的溶液中HX-的电离程度大于其水解,溶液显酸性,即c(H+)>c(OH-),故C错误;D、NaHX的水溶液显酸性,因此溶液显中性时,溶质为NaHX和Na2X,HX-的电离平衡常数Ka2=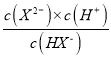 =10-5×10-0.4=10-5.4,X2-的水解平衡常数=
=10-5×10-0.4=10-5.4,X2-的水解平衡常数=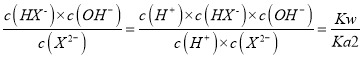 =10-8.6<10-5.4,说明HX-的电离程度大于X2-水解程度,NaHX和Na2X浓度相等时,溶液显酸性,因此Na2X的浓度应大于NaHX,溶液显中性,即离子浓度大小顺序是c(Na+)>c(X2-)>c(HX-)> c(H+)=c(OH-),故D正确。
=10-8.6<10-5.4,说明HX-的电离程度大于X2-水解程度,NaHX和Na2X浓度相等时,溶液显酸性,因此Na2X的浓度应大于NaHX,溶液显中性,即离子浓度大小顺序是c(Na+)>c(X2-)>c(HX-)> c(H+)=c(OH-),故D正确。


科目:高中化学 来源: 题型:
【题目】下列叙述错误的是( )
A.10mL质量分数为98%的H2SO4 , 用10mL水稀释后,H2SO4的质量分数大于49%
B.配制0.1mol/L的Na2CO3溶液480mL,需用500mL容量瓶
C.在标况下,将22.4L氨气溶于1L水中,得到1mol/L的氨水
D.同温同压下,20mLCH4和60mLO2所含的原子数之比为5:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既是氧化还原反应,又是吸热反应的是
A. 实验室制备氢气 B. 灼热的碳与水的反应
C. Ba(OH)2·8H2O与NH4Cl的反应 D. 铝粉与氧化铁粉末反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能说明NH3·H2O一定是弱电解质的是
①常温下,NH3·H2O溶液能使酚酞变红; ②用NH3·H2O溶液做导电性实验,灯泡很暗;
③常温下,0.1mol / L氯化铵溶液的pH约为5
④常温下,体积相同且pH相同的NH3·H2O溶液和NaOH溶液,与相同浓度的HCl溶液中和时,消耗HCl溶液的体积:前者>后者
A.①②③④ B.②③④ C.③④ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中能表示阿伏伽德罗常数数值的是( )
A.1mol H+含有的电子数
B.标准状况下,22.4L酒精所含的分子数
C.1.6 g CH4 含有的质子数
D.1L 1mol/L的硫酸钠溶液所含的Na+ 数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的说法中,正确的是:
A. 苯分子为平面正六边形结构,6个碳原子之间的键完全相同
B. 从苯的结构看,分子中含有单、双键,所以能使酸性高锰酸钾溶液和溴的四氯化碳溶液因反应而褪色
C. 在催化剂存在下,苯能与溴水发生取代反应,生成溴苯
D. 苯是一种密度比水大,不溶于水的有特殊气味的无色液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯酸(CH2 = CH — COOH)的性质可能有( )
① 加成反应 ② 取代反应 ③ 酯化反应 ④ 中和反应 ⑤ 氧化反应
A. 只有①③ B. 只有①③④ C. 只有①③④⑤ D. ①②③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com