
| A. | 常温常压下,22.4 L CO2中含有NA个CO2分子 | |
| B. | 1.7 g H2O2中含有的电子数为0.9NA | |
| C. | 标准状况下,2.24 L乙醇含有的分子数等于0.1NA | |
| D. | 分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g |
分析 A、常温常压下气体摩尔体积大于22.4L;
B、求出双氧水的物质的量,然后根据双氧水中含18个电子来分析;
C、标况下乙醇为液体;
D、混合气体所处的状态不明确.
解答 解:A、常温常压下气体摩尔体积大于22.4L,故22.4L二氧化碳的物质的量小于1mol,故含有的分子个数小于NA个,故A错误;
B、1.7g双氧水的物质的量为0.05mol,而双氧水中含18个电子,故0.05mol双氧水中含0.9NA个电子,故B正确;
C、标况下乙醇为液体,故不能根据气体摩尔体积来计算其物质的量,故C错误;
D、混合气体所处的状态不明确,故NA个CO和乙烯分子的混合气体的体积无法计算,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 稀醋酸与0.1 mol•L-1NaOH反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1 | |
| B. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热充分反应,放出19.12 kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ•mol-1 | |
| C. | 已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| D. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则可知C的燃烧热△H=-110.5 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60克SiO2含有2NA个Si-O共价键 | |
| B. | 实验室中用含4molHCl的浓盐酸跟足量MnO2加热反应可制得Cl2的分子数为NA | |
| C. | 1L 0.2mol•L-1Al2(SO4)3溶液中的离子总数为NA | |
| D. | 标准状况下,22.4mLH2O约含有 3.73NA个原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 300 mL、1mol•L-1NaCl溶液 | B. | 75 mL、2mol•L-1CaCl2溶液 | ||
| C. | 150 mL、2mol•L-1KCl溶液 | D. | 75 mL、1mol•L-1AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
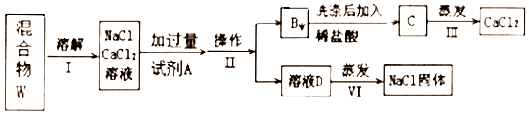
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 催化剂是影响化学反应速率的主要因素 | |
| B. | 化学反应的反应热与反应途径无关 | |
| C. | 增大压强一定能增大化学反应速率 | |
| D. | 反应物分子间发生碰撞即可发生化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
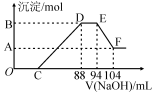 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.现有一定量铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入2mol.L-l的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)关系如图所示,下列说法不正确的是( )
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.现有一定量铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入2mol.L-l的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)关系如图所示,下列说法不正确的是( )| A. | 反应前的溶液中,硝酸的物质的量为0.2 mol | |
| B. | C点对应NaOH溶液的体积为48 mL | |
| C. | 样品中铝粉和铁粉的物质的量之比为5:3 | |
| D. | D点与A点沉淀物质的量的差为0.02 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=-890.3 kJ•mol-1(燃烧热) | |
| B. | 同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 | |
| C. | CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| D. | 已知:2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2;则△H1<△H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com