
| A. | 40.0% | B. | 58.6% | C. | 60.0% | D. | 47.1% |
分析 wg镁粉和铝粉的混合物,与盐酸反应生成氯化镁和氯化铝,再与过量氢氧化钠溶液反应后得到的沉淀为氢氧化镁,将氢氧化镁加热得到的固体为MgO,取出蒸发皿中的物质称量仍为wg,根据质量守恒定律,铝粉的质量等于MgO中O元素的质量,以此计算原混合物中铝粉的质量分数.
解答 解:wgMg粉和铝粉的混合物,与盐酸反应生成氯化镁和氯化铝,再与过量氢氧化钠溶液反应后得到的沉淀为氢氧化镁,将氢氧化镁加热得到的固体为MgO,取出蒸发皿中的物质称量仍为wg,根据质量守恒定律,原混合物中铝粉的质量等于MgO中O元素的质量,则原混合物中铝粉的质量分数=MgO中氧元素的质量分数=$\frac{16}{40}$×100%=40%,故选A.
点评 本题考查混合物反应的计算,题目难度中等,本题注意分析金属混合物反应前后物质的成分的变化,试题侧重考查学生的分析、理解能力及化学计算能力.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:选择题
| A. | 淀粉和纤维素分子式均为(C6H10O5)n,它们水解的最终产物都是葡萄糖,因此淀粉和纤维素互为同分异构体 | |
| B. | 通过蒸馏法、电渗析法、离子交换法等可以实现海水的淡化 | |
| C. | 多糖、蛋白质、油脂均能水解,它们属于天然高分子化合物 | |
| D. | 石油的分馏、煤的干馏、煤的气化和液化均属于物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度/℃ | 起始浓度 | 平衡浓度 | |
| CO(g) | H2O(g) | H2(g) | |
| 900 | 2.0 | 0.8 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
. .
. 或
或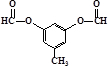 .
. 与G互为同分异构体
与G互为同分异构体查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50 s的平均速率v(PCl3)=0.0032 mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol•L-1,则反应的△H<0 | |
| C. | 相同温度下,起始时向容器中充入1.0molPCl5、0.20 mol PCl3 和0.20molCl2,反应达到平衡前v(正)>v(逆) | |
| D. | 相同温度下,起始时向容器中充入2.0molPCl3 和2.0molCl2,达到平衡时,PCl3的转化率小于80% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(A2)=0.4 mol•L-1•s-1 | B. | V(B2)=0.6 mol•L-1•s-1 | ||
| C. | V(AB3)=0.5 mol•L-1•s-1 | D. | V(B2)=18 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 滴入KMnO4溶液的次序 | KMnO4溶液紫色褪去所需的时间 |
| 先滴入第1滴 | 60s |
| 褪色后,再滴入第2滴 | 15s |
| 褪色后,再滴入第3滴 | 3s |
| 褪色后,再滴入第4滴 | 1s |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 随核电荷数增加卤素原子半径增大 | B. | 随核电荷数增加,单质熔沸点升高 | ||
| C. | 随核电荷数增加,单质氧化性增强 | D. | 随核电荷数增加氢化物越来越稳定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com