
| A、液面在“0”刻度时,50 mL碱式滴定管和25 mL碱式滴定管所盛液体的体积 |
| B、相同温度下,0.2 mol?L-1醋酸溶液和0.1 mol?L-1醋酸溶液中的c(H+) |
| C、在FeCl2溶液中,c(Cl-)与c(Fe2+) |
| D、在0.1 mol?L-1NaHSO4溶液中,阳离子数与阴离子数 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
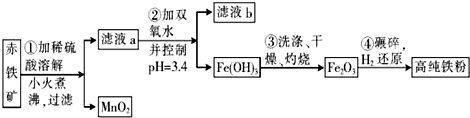
| 沉淀物 | AI(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 关于反应3O2(g)═2O3(g),反应过程中能量的变化如图所示.下列有关该反应的△H、△S的说法中正确的是( )
关于反应3O2(g)═2O3(g),反应过程中能量的变化如图所示.下列有关该反应的△H、△S的说法中正确的是( )| A、△H<0△S<0 |
| B、△H>0△S<0 |
| C、△H<0△S>0 |
| D、△H>0△S>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
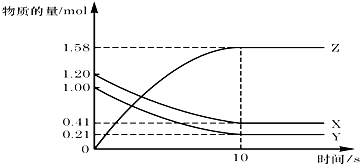
| A、该反应中,X和Y是生成物,Z是反应物 |
| B、反应开始到10s,用Z表示的反应速率为0.158mol/(L?s) |
| C、反应开始10s,Y的转化率为79.0% |
| D、反应的化学方程式为:X(g)+Y(g)?Z(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、冶炼过程中的尾气可用来制硫酸 |
| B、上述过程中,由1molCuFeS2制取1molCu时共消耗2molO2 |
| C、在反应2Cu2O+Cu2S═6Cu+SO2↑中,只有Cu2O作氧化剂 |
| D、电解精炼铜的过程中,每转移1 mol电子时,阳极溶解铜的质量为32 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com