
| A. | 脱落酸 | B. | 乙烯 | C. | 生长素 | D. | 甲烷 |
分析 这种“气”是指乙烯,因为乙烯的主要作用是促进果实成熟;脱落酸的主要作用是抑制细胞分裂,促进叶和果实的衰老和脱落;生长素的作用表现出两重性:既能促进生长也能抑制生长;既能促进发芽也能抑制发芽;既能防止落花落果也能疏花疏果;甲烷为气体,不具有催熟作用,以此来解答.
解答 解:A.脱落酸的主要作用是抑制细胞分裂,促进叶和果实的衰老和脱落,故A不选;
B.该文中的“气”是指乙烯,得气即发可知乙烯催熟果实,故B选;
C.生长素具有两重性既能促进生长也能抑制生长,既能促进发芽也能抑制发芽,既能防止落花落果也能疏花疏果,故C不选;
D.甲烷为气体,不具有催熟作用,故D不选;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握习题中的信息及乙烯的催熟作用为解答的关键,侧重分析与应用能力的考查,注意生物与化学的联系,题目难度不大.


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 71g氯气中氯原子数为NA | |
| B. | 标准状况下,22.4LNH3所含的电子数为10NA | |
| C. | 5.6gFe在足量氯气中燃烧转移的电子数为2NA | |
| D. | 标准状况下,11.2L H2O中含有分子的数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{m-n}{3}$mL | B. | $\frac{n-m}{3}$mL | C. | $\frac{4m-n}{3}$mL | D. | $\frac{3}{m-n}$mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
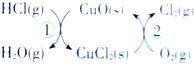 示).
示).| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| N2O4浓度 (mol/L) | 0.10 | 0.06 | C1 | 0.04 | 0.04 |
| NO2浓度 (mol/L) | 0 | 0.08 | C2 | 0.12 | 0.12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和l00g 10.00%的K2SO4溶液.电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和l00g 10.00%的K2SO4溶液.电极均为石墨电极.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com