
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
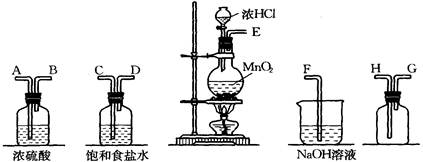
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
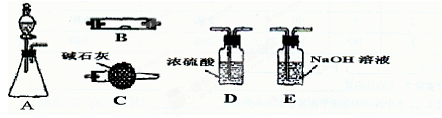
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 滴定次数 | 盐酸 体积 体积 | NaOH溶液体积读数(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.00 | 18.10 |
| 2 | 20.00 | 0.00 | 16.30 |
| 3 | 20.00 | 0.00 | 16.22 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 (9分)已知NH3与CuO在加热条件下可生成N2,方程式为2NH3+3CuO3Cu+N2+3H2O。纯氮气跟镁在高温下反应可得到氮化镁,氮化镁遇水反应可生成氢氧化镁和氨气。
(9分)已知NH3与CuO在加热条件下可生成N2,方程式为2NH3+3CuO3Cu+N2+3H2O。纯氮气跟镁在高温下反应可得到氮化镁,氮化镁遇水反应可生成氢氧化镁和氨气。

| A.硫酸铵固体与消石灰共热 | B.浓氨水逐滴加到新制的生石灰中 |
| C.在一定条件下,氮气与氢气化合 | D.加热分解氯化铵固体 |
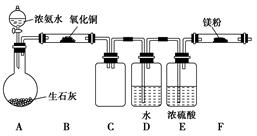
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 %的浓硫酸(ρ= 1.84g/cm3)配制浓度为0.5 mol/L的稀硫酸500mL。有以下几步操作,请按要求回答下列问题:
%的浓硫酸(ρ= 1.84g/cm3)配制浓度为0.5 mol/L的稀硫酸500mL。有以下几步操作,请按要求回答下列问题:  。
。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
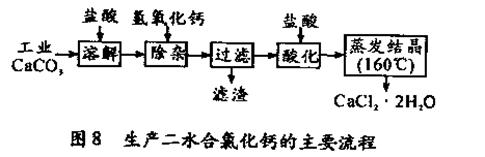
 。
。 。
。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
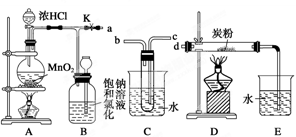
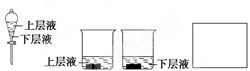
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com