
【题目】下列离子方程式的书写中正确的是
A.氢氧化镁与盐酸反应:H++OH-=H2O
B.铁与盐酸反应:2Fe+6H+=2Fe3++3H2
C.氧化铝溶于稀硫酸:Al2O3+6H+=2Fe3++3H2O
D.向沸水中滴加FeCl3溶液制备Fe(OH)3 胶体:Fe3++3H2O=Fe(OH)3+3H+
科目:高中化学 来源: 题型:
【题目】短周期主族元素R、X、Y 、Z的原子序数依次增大,化合物M、N均由这四种元素组成,且M的相对分子质量比N小16。分别向M和N中加入烧碱浓溶液并加热,二者均可产生使湿润的红色石蕊试纸变蓝的气体。下列说法错误的是
A.X 形成的某阳离子X5+中每个X都达到8电子结构
B.M和N可能发生反应
C.R与Y形成的具有漂白性的物质和Y与Z形成的具有漂白性的物质等物质的量混合后漂白性增强
D.X和Z的最简单气态氢化物之间反应能生成两种盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F、G,它们之间能发生如图反应(图中有些反应的产物和反应的条件没有全部标出)。

请根据以上信息回答下列问题:
(1)写出下列物质的化学式:乙_________,F__________。
(2)写出下列反应的离子方程式:
①金属A和水反应_______________。②红褐色沉淀C与物质E反应__________。
③F与黄绿色气体乙反应____________。
④实验室常用氢氧化钠吸收实验过程中的黄绿色气体乙,写出用氢氧化钠溶液吸收该气体的离子方程式___。
(3)将G溶液逐滴加入到沸水中会产生一种红褐色的液体。你认为该液体中的分散质粒子直径在______之间,验证的简单方法是:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器的名称、组装及使用方法是中学化学实验的基础。如图为两套实验装置。

(1)写出下列实验仪器的名称A___;B___;C__;D___。
(2)用装置1分离四氯化碳和Br2的混合物,实验操作的名称为___,冷凝管的进水口是___;(填a或b);
(3)现需配制480mL 0.2mol/L KOH溶液,需要称量KOH___g,配制过程中所用到的仪器有托盘天平、烧杯、___、___、胶头滴管。
(4)装置2是某同学转移溶液的示意图,图中的错误是___。
(5)下列操作会引起浓度偏高的是___。
A.溶液未冷却到室温就转移至容量瓶中 B.称量固体时将右边放药品与左边放砝码
C.定容时仰视读数 D.容量瓶中的水未除尽
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的检验说法不正确的是( )
A.加入氯化钡溶液有白色沉淀生成,再加稀硝酸沉淀不消失,一定含有![]()
B.观察钾元素焰色反应的操作是:将铂丝用稀盐酸洗涤后灼烧至火焰为无色,然后再用铂丝蘸取固体氯化钾,置于酒精灯的火焰上进行灼烧,透过蓝色钴玻璃进行观察
C.待检液加入NaOH溶液并加热,有能使湿润的红色石蕊试纸变蓝的气体生成,则原溶液中一定含有![]()
D.待检液加入氯化钡溶液有白色沉淀生成,再加入足量盐酸沉淀消失且产生无色无味的气体,则待检液中一定含有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L容器中X、Y、Z三种气体物质的量随时间的变化关系曲线如图所示。
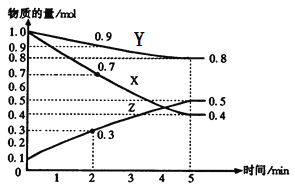
(1)由图中的数据分析,该反应的化学方程式为_____________________。
(2)反应开始至5min,Z的平均反应速率为__________;
(3)反应开始至5min,正反应速率逐渐______;(填“增大”“减小”)逆反应速率逐渐______,(填“增大”“减小”)5min后Z的物质的量不再改变,原因是下列的________;
A.正逆反应都停止了
B.正反应速率为零
C.正逆反应速率相等,反应达到平衡状态
D.逆反应速率为零
(4)下列措施一定能使正反应速率增大的是______。
A.升高温度 B.降低温度
C.增大Y的浓度 D.减少Z的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,水溶液中pH和pOH的关系如图所示,已知pH=-lgc(H+),pOH=-lgc(OH-)。下列说法一定正确的是( )

A.水的电离程度,B>A>D
B.lmolL-1Na2SO4溶液不可能处于B点
C.向C点水溶液中通入HCl,则C点变为E点
D.0.1molL-1NaHA溶液的pH和pOH的关系如图中E点所示,此时溶液中离子的物质的量浓度关系:c(HA-)>c(A2-)>c(H2A)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定硫酸铜晶体(CuSO4xH2O)中x值的实验过程如下:

完成下列填空:
(1)必须要进行恒重操作的原因是___。
(2)下面是某同学的一次实验记录,请完成下表。
称量数据1 | 称量数据2 | 称量数据3 | 结晶水的X值 | 实验误差 |
11.685g | 13.691g | 12.960g | ____ | ____ |
(3)本次实验测得X值偏__(高、低),可能这次实验中产生误差的原因可能是___。
A.硫酸铜晶体中含有不挥发性杂质 B.实验前晶体表面有湿存水
C.加热时有晶体飞溅出去 D.加热失水后露置在空气中冷却
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在人类的生产和生活中有着广泛的应用,某化学兴趣小组利用图一装置探究氨气的有关性质。
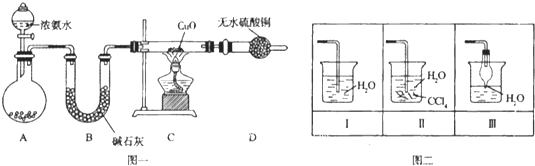
(1)装置A中烧瓶内试剂可选用 (填序号)。B的作用是
a.碱石灰 b.浓硫酸 c.生石灰 d.烧碱溶液
(2)连接好装置并检验装置的气密性后,装入药品,然后应先 (填I或Ⅱ).
Ⅰ.打开旋塞逐滴向圆底烧瓶中加入氨水 Ⅱ.加热装置C
(3)实验中观察到C中CuO粉末变红,D中无水硫酸铜变蓝,并收集到一种单质气体,则该反应相关化学方程式为 ,.该反应证明氨气具有 性.
(4)该实验缺少尾气吸收装置,图二中能用来吸收尾气的装置是 (填装置序号).
(5)氨气极易溶于水,若标准状况下,将2.24L的氨气溶于水配成0.5L溶液,所得溶液的物质的量浓度为 mol/L.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com