下表是元素周期表的一部分,请从表中所标明的十种元素中回答下列有关问题:
| 
| 族序数
(1) K C (此问每空1分,其余每空2分) (2)2Al+2OH-+6H2O=2Al(OH)4-+3H2↑ (3)电子式 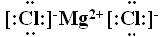 ; 离子键 ; 离子键 (4)I-
练习册系列答案
相关习题
科目:高中化学
来源:
题型:
下表是元素周期表的一部分,请回答有关问题:
主族
周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
|
|
|
① |
② |
|
③ |
|
| 3 |
④ |
⑤ |
⑥ |
|
|
⑦ |
⑧ |
⑨ | (1)最活泼的非金属元素是 F F (用元素符号或化学式表示,下同);碱性最强的是 NaOH NaOH ,该物质存在的化学键类型是 离子键、共价键 离子键、共价键 (2)⑤元素与⑧元素形成化合物的电子式是 (3)③⑦⑧三种元素原子半径由小到大的顺序是 F<Cl<S F<Cl<S (4)将⑤⑥两种单质用导线相连后,同时浸入稀硫酸中,⑥这一极发生 还原 还原 (填“氧化”或“还原”)反应.
查看答案和解析>>
科目:高中化学
来源:
题型:
下表是元素周期表的一部分,表中的序号分别代表某一种化学元素.请按要求完成下列问题:  (1)写出元素⑦的元素名称 硫 硫 . (2)元素?在元素周期表中的位置是 四 四 周期, ⅤⅢ ⅤⅢ 族. (3)用元素符号将①、②、③、⑥四种元素按原子半径由大到小的顺序排列 Na>Si>N>F Na>Si>N>F . (4)在这些元素中,最活泼的金属元素是 K K (填元素符号,下同),最活泼的非金属元素是 F F ,最不活泼的元素是 Ar Ar . (5)写出③、⑤两种元素的最高价氧化物对应的水化物反应的离子方程式 OH-+Al(OH)3=[Al(OH)4]- OH-+Al(OH)3=[Al(OH)4]- . (6)写出①元素形成的4核10电子微粒的化学式 NH3 NH3 .
查看答案和解析>>
科目:高中化学
来源:
题型:
下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
|
|
|
|
|
|
|
A |
B |
C |
D |
E |
|
F |
G |
H |
|
|
|
|
|
|
I |
|
|
|
|
J |
|
|
|
|
K |
|
|
|
|
|
| L |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
M |
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
| 试回答下列问题: (1)I的元素符号为 Sc Sc ,K的元素名称为 镓 镓 . (2)写出基态时J元素原子的电子排布式 1s22s22p63s23p63d64s2 1s22s22p63s23p63d64s2 ,N元素原子的简化电子排布式 [Xe]4f145d106s26p5 [Xe]4f145d106s26p5 . (3)下列对比正确的是 cd cd . a.原子半径H>G>B>A; b.第一电离能E>D>C>B; c.电负性A>H>G>K; d.最高价氧化物的水化物酸性B>A>H>G; (4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述不正确的是 bc bc . a.L位于元素周期表中第五周期、ⅠA族,属于s区元素; b.O位于元素周期表中第七周期、ⅧB族,属于d区元素; c.M的外围电子排布式为6s 1,属于ds区元素; d.H所在族的外围电子排布式为ns 2np 2,属于p区元素; (5)短周期中某种元素的最高价氧化物1mol与12molNaOH恰好完全反应生成正盐,该元素在元素周期表中的位置为 三 三 周期 ⅤA ⅤA 族.
查看答案和解析>>
科目:高中化学
来源:
题型:
下表是元素周期表的一部分,表中所列字母分别代表某一化学元素.
(1)i是铁元素,其原子的最外层电子数为2,请写出铁元素的原子结构示意图 . (2)由以上元素形成的金属单质中,熔点最低的是 Na Na .(填元素符号) (3)NH 3?H 2O的电离方程式为NH 3?H 2O  NH 4++OH -,试判断NH 3溶于水后,形成的NH 3?H 2O的合理结构是 (b) (b) (填序号).  (4)1906年的诺贝尔化学奖授予为制备F 2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F 2反应制备稀有气体化合物的元素是 j j (填写字母). (5)利用稀有气体化合物,人们实现了许多制备实验上的突破.如用XeO 3在碱性条件下与NaBrO 3反应生成NaBrO 4,同时放出Xe.写出上述反应方程式: XeO3+3NaBrO3═3NaBrO4+Xe↑ XeO3+3NaBrO3═3NaBrO4+Xe↑ . (6)a与g形成的化合物是 共价 共价 (填“离子”或“共价”)化合物.
查看答案和解析>>
科目:高中化学
来源:
题型:
下表是元素周期表的一部分,针对所给的11种元素,完成下列各小题.
| 周期 主族 |
IA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅥⅠA |
0 |
| 2 |
|
|
|
C |
N |
O |
F |
|
| 3 |
Na |
Mg |
|
Si |
|
S |
Cl |
Ar |
| 4 |
|
Ca |
|
|
|
|
|
| (1)化学性质最不活泼的元素是 (填元素名称); (2)Cl原子结构示意图为 ; (3)第三周期元素中,最高价氧化物对应水化物碱性最强的是 (填化学式); (4)O和N中,原子半径较大的是 ; (5)“高钙牛奶”中的钙是指 (填“元素”或“单质”); (6)Cl的气态氢化物的稳定性比F的气态氢化物 (填强或弱); (7)常温下为红棕色气体的氧化物的化学式是 . (8)镁是一种重要的金属材料,工业上采用电解熔融氯化镁获得金属镁,该反应的化学方程式为 ; (9)S元素形成的一种氢化物的化学式是 ,该物质中H元素与S元素的质量比m(H):m(S)= .(相对原子质量:H-1 S-32)
查看答案和解析>>
| | |
