
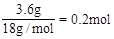 £¬ŗ¬ÓŠ0.4molH”£
£¬ŗ¬ÓŠ0.4molH”£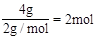 £¬11.2LO2µÄĪļÖŹµÄĮæĪŖ
£¬11.2LO2µÄĪļÖŹµÄĮæĪŖ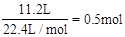 £¬ÖŹĮæĪŖ16g£¬1molH2OµÄÖŹĮæĪŖ18g”£Ņņ“Ėŗ¬·Ö×ÓŹż×ī¶ąµÄŹĒH2”£ÖŹĮæ×ī“óµÄŹĒH2O”£
£¬ÖŹĮæĪŖ16g£¬1molH2OµÄÖŹĮæĪŖ18g”£Ņņ“Ėŗ¬·Ö×ÓŹż×ī¶ąµÄŹĒH2”£ÖŹĮæ×ī“óµÄŹĒH2O”£


| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®±ź×¼×“æöĻĀ£¬22.4LČĪŅā±Č»ģŗĻµÄH2ŗĶCO2µÄĘųĢåÖŠŗ¬ÓŠµÄ·Ö×Ó×ÜŹż¾łĪŖNA |
| B£®Ė®µÄĦ¶ūÖŹĮæµČÓŚNAøöĖ®·Ö×ÓµÄĻą¶Ō·Ö×ÓÖŹĮæÖ®ŗĶ |
| C£®±ź×¼×“æöĻĀ£¬5.6LĖÄĀČ»ÆĢ¼ŗ¬ÓŠµÄ·Ö×ÓŹżĪŖ0.25NA |
| D£®·Ö±šÓÉNAøöĖ®·Ö×Ó×é³ÉµÄ±ł”¢Ė®”¢Ė®ÕōĘųµÄÖŹĮæø÷²»ĻąĶ¬ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗ¼ĘĖćĢā
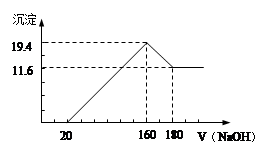
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®1L H2SO4ČÜŅŗÖŠŗ¬ÓŠ98g H2SO4£¬ŌņøĆČÜŅŗµÄĪļÖŹµÄĮæÅضČĪŖ98g/L |
| B£®1LH2OÖŠČܽāĮĖ0.5molNaCl£¬ŌņøĆČÜŅŗµÄĪļÖŹµÄĮæÅضČĪŖ0.5mol/L |
| C£®“Ó1L 1mol/L ÕįĢĒČÜŅŗÖŠČ”³ö100mLČÜŅŗ£¬ĘäĪļÖŹµÄĮæÅضČČŌĪŖ1mol/L |
| D£®0.5mol/L µÄNaOHČÜŅŗÖŠ£¬ŗ¬ÓŠ0.5mol Na+ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®ĘųĢåĦ¶ūĢå»ż¾ĶŹĒ22.4L/mol |
| B£®ŌŚ±ź×¼×“æöĻĀ£¬1molČĪŗĪĘųĢåĖłÕ¼µÄĢå»ż¶¼ŹĒ22.4L/mol |
| C£®ŌŚ±ź×¼×“æöĻĀ£¬1molČĪŗĪĘųĢåĖłÕ¼µÄĢå»ż¶¼Ō¼ŹĒ22.4L |
| D£®ŌŚ±ź×¼×“æöĻĀ£¬1molĖ®ĖłÕ¼µÄĢå»żŌ¼ĪŖ22.4L |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®23g½šŹōÄʱäĪŖÄĘĄė×ÓŹ±Ź§Č„µÄµē×ÓŹżĪŖNA |
| B£®12 g C-13ŗ¬ÓŠµÄŌ×ÓŹżĪŖNAøö |
| C£®±ź×¼×“æöĻĀ£¬22.4 Lŗ¤ĘųĖłŗ¬µÄŌ×ÓŹżÄæĪŖ2NA |
| D£®³£ĪĀ³£Ń¹ĻĀ£¬28g N2ŗĶCOµÄ»ģŗĻĘųĢåĖłŗ¬Ō×ÓŹżĪŖNA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®10mL 1mol/L (NH4)2SO4ČÜŅŗ | B£®50mL 0.2mol/L NH4ClČÜŅŗ |
| C£®10mL 0.2mol/L(NH4)2SO4ČÜŅŗ | D£®200mL 0.1mol/L NH4NO3ČÜŅŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®ĻĖĪ¬ĖŲĖ®½āÓėµķ·ŪĖ®½āµĆµ½µÄ×īÖÕ²śĪļ²»Ķ¬ |
| B£®3.36L±ūĻ©ÖŠŗ¬ÓŠµÄ¹²ÓƵē×Ó¶ŌŹżĪŖ1.5NA |
| C£®ŹŌ¹ÜĄļ¼ÓČėÉŁĮæµķ·Ū£¬ŌŁ¼ÓČėŅ»¶ØĮæĻ”ĮņĖį£¬¼ÓČČ3”«4·ÖÖÓ£¬Č»ŗó¼ÓČėŅų°±ČÜŅŗ£¬Ę¬æĢŗó¹Ü±ŚÉĻÓŠ”°Ņų¾µ”±³öĻÖ |
| D£®¶ÆĪļʤøļµÄÖ÷ŅŖ³É·ÖŹĒµ°°×ÖŹ£¬ĒŅĢģČ»µ°°×ÖŹĖ®½āµÄ×īÖÕ²śĪļŹĒ°±»łĖį |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®2øö | B£®3øö | C£®4øö | D£®5øö |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com