
 第四周期的Cr、Fe、Co、Ni、Cu、Zn等许多金属能形成配合物.
第四周期的Cr、Fe、Co、Ni、Cu、Zn等许多金属能形成配合物.| 6+2-2×4 |
| 2 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:2010年山东青岛市高三第二次模拟练习 题型:填空题
(8分)【化学—物质结构与性质】
第四周期的Cr、Fe、Co、Ni、Cu、Zn等许多金属能形成配合物。
(1)Cr的核外电子排布式为 ;
(2)科学家通过X射线测得胆矾结构示意图可简单表示如下: 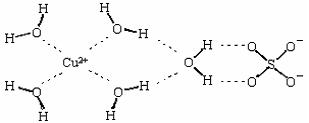
图中虚线表示的作用力为 ;
(3)胆矾溶液与氨水在一定条件下可以生成Cu(NH3)4SO4·H2O晶体。在Cu(NH3)4SO4·H2O晶体中,[Cu(NH3)4]2+为平面正方形结构,则呈正四面体结构的原子团是 ,其中心原子的杂化轨道类型是 ;
(4)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈正四面体构型。试推测四羰基镍的晶体类型是 , Ni(CO)4易溶于下列 。
| A.水 | B.四氯化碳 | C.苯 | D.硫酸镍溶液 |
查看答案和解析>>
科目:高中化学 来源:期末题 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:
【化学—物质结构与性质】
第四周期的Cr、Fe、Co、Ni、Cu、Zn等许多金属能形成配合物。
(1)Cr的核外电子排布式为 ;
(2)科学家通过X射线测得胆矾结构示意图可简单表示如下:
图中虚线表示的作用力为 ;
(3)胆矾溶液与氨水在一定条件下可以生成Cu(NH3)4SO4·H2O晶体。在Cu(NH3)4SO4·H2O晶体中,[Cu(NH3)4]2+ 为平面正方形结构,则呈正四面体结构的原子团是 ,其中心原子的杂化轨道类型是 ;
(4)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈正四面体构型。试推测四羰基镍的晶体类型是 , Ni(CO)4 易溶于下列 。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com