
| A. | CO(g)的燃烧热是283.0 kJ/mol,则表示CO燃烧热的热化学方程式为2CO(g)+O2(g)═2CO2(g);△H=-566.0 kJ/mol | |
| B. | 由石墨比金刚石稳定可知:C(金刚石,s)=C(石墨,s);△H<0 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 已知:2SO2 (g)+O2(g)?2SO3 (g);△H=-98.3 kJ/mol.将1 mol SO2和0.5 mol O2充入一密闭容器中反应,放出49.15 kJ的热量 |
分析 A.燃烧热的热化学方程式中,可燃物的物质的量必须为1mol,即CO的系数必须为1;
B.物质具有的能量越高,物质的稳定性越弱,结合该反应为放热反应分析;
C.反应条件与反应热没有必然关系,则需要加热才能发生的反应不一定是吸热反应;
D.该反应为可逆反应,反应物不可能完全转化成生成物,则反应放出热量减少.
解答 解:A.燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量,表示CO(g)燃烧热的热化学方程式为CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0KJ/mol,故A错误;
B.根据反应C(金刚石,s)=C(石墨,s)△H<0可知,该反应为放热反应,说明金刚石具有的能量大于金刚石,则石墨比金刚石稳定,故B正确;
C.需要加热才能发生的反应不一定是吸热反应,如铝热反应、氢气还原氧化铜等反应都是放热反应,但是该反应需要在加热条件下进行,故C错误;
D.已知:2SO2 (g)+O2(g)?2SO3 (g)△H=-98.3 kJ/mol,说明2mol二氧化硫完全转化成2mol三氧化硫放出98.3kJ热量;若将1 mol SO2和0.5 mol O2充入一密闭容器中反应,由于该反应为可逆反应,则反应生成三氧化硫的物质的量一定小于1mol,反应放出热量一定小于98.3 kJ/mol×$\frac{1mol}{2mol}$=49.15 kJ,故D错误;
故选B.
点评 本题考查热化学方程式的书写及应用,题目难度中等,明确燃烧热概念、可逆反应特点为解答关键,B为易错点,注意掌握物质稳定性与物质具有能量的关系,试题侧重考查学生的灵活应用能力.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2溶液中加入过量Al2(SO4)3溶液:3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓ | |
| B. | FeCl3溶液中加少量Na2S溶液:2Fe3++S2-=2Fe2++S↓ | |
| C. | 向硫酸铜溶液中加入过量氨水:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+ | |
| D. | 向Ca(OH)2溶液中加入过量的NaHCO3溶液:Ca2++2HCO3-+2OH-=CO32-+CaCO3↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | OH-的电子式: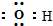 | |
| B. | F-的结构示意图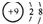 | |
| C. | N2的结构式: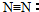 | |
| D. | 碳酸氢钠的电离方程式:NaHCO3=Na++H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 反应① | 反应② |
| A | 向AgNO3溶液中滴加稀盐酸 | AgNO3溶液与食盐水混合 |
| B | 过量CO2通入NaOH溶液中 | 过量CO2通入澄清石灰水中 |
| C | 向烧碱溶液中滴加稀盐酸 | 向H2SO4溶液中滴加KOH溶液 |
| D | 向BaCl2溶液中滴加稀硫酸 | 向Ba(OH)2溶液中滴加CuSO4溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳碳双键
碳碳双键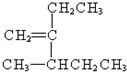 3-甲基-2-乙基-1-戊烯④
3-甲基-2-乙基-1-戊烯④ 2-甲基戊烷
2-甲基戊烷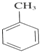 +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$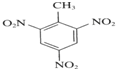 +3H2O.
+3H2O.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
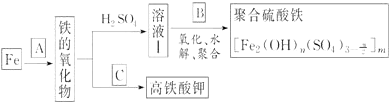
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1说明2molH2(g)和1molO2(g)的能量总和小于2molH2O(g)的能量 | |
| B. | 已知C(石墨,s)=C(金刚石,s);△H>0,则金刚石比石墨稳定 | |
| C. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4kJ•mol-1,则含20gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量 | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1; 2C(s)+O2(g)=2CO(g)△H2;则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Cl2与常温下氢氧化钠溶液充分反应时转移的电子数为2NA | |
| B. | 1molCu与足量的硫固体反应转移的电子数为NA | |
| C. | 常温下,1 L 0.1 mol/L MgCl2溶液中含Mg2+数为0.1NA | |
| D. | 标准状况下,2.24L三氧化硫所含分子数为0.1 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com