
【题目】氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为:N2(g)+3H2(g)![]() 2NH3(g) △H
2NH3(g) △H
(1)已知破坏1mol共价键需要的能量如表所示
H-H | N-H | N-N | N≡N |
435.5kJ | 390.8kJ | 163kJ | 945.8kJ |
则△H=__________。
(2)在恒温、恒压容器中,按体积比1:3加入N2和H2进行合成氨反应,达到平衡后,再向容器中充入适量氨气,达到新平衡时,c(H2)将__________(填“增大”、“减小”、或“不变”,后同);若在恒温、恒容条件下c(N2)/c(NH3)将________。
(3)在不同温度、压强和使用相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol 时,平衡混合物中氨的体积分数(φ)如图所示。

①其中,p1、p2和p3由大到小的顺序是_______,原因是___________________。
②若在250℃、p1条件下,反应达到平衡时的容器体积为1L,则该条件下合成氨的平衡常数K=____(结果保留两位小数)。
(4)H2NCOONH4是工业由氨气合成尿素的中间产物。在一定温度下、体积不变的密闭容器中发生反应H2NCOONH4(s)![]() 2NH3(g)+CO2(g),能说明该反应达到平衡状态的是_____(填序号)
2NH3(g)+CO2(g),能说明该反应达到平衡状态的是_____(填序号)
①每生成34g NH3的同时消耗44g CO2 ②混合气体的密度保持不变
③NH3的体积分数保持不变 ④混合气体的平均相对分子质量不变 ⑤c(NH3):c(CO2)=2:1
(5)科学家发现,N2和H2组成的原电池合成氨与工业合成氨相比具有效率高,条件易达到等优点。其装置如图所示、写出该原电池的电极反应:________________、_____________,若N2来自于空气,当电极B到A间通过2molH+时理论上需要标况下空气的体积为_________(结果保留两位小数)。

【答案】 -92.5kJ/mol(1分) 不变 减小 p1>p2>p3 该反应的正反应为气体体积减小的反应,相同温度下,增大压强平衡正移,NH3 的体积分数增大,由图可知p1>p2>p3 5.93×103 (mol/L)-2 或 5925.93(mol/L)-2 ①② N2+6e-+6H+=2NH3 3H2-6e-=6H+ 9.33L
【解析】⑴△H=E断-E成=945.8+3×435.5-6×390.8=-92.5 kJ/mol ⑵在恒温恒压条件下通NH3相当于平衡不移动,所以不变;恒温恒容条件下相当于加压,平衡正移,比值减小;⑶该反应的正反应为气体体积减小的反应,增大压强平衡正移。NH3 的体积分数增大,由图可知p1>p2>p3。 由图可知氨气的体积分数为0.667,根据三段式可计算出c(NH3)=0.16mol/L c(N2)=0.02mol/L c(H2)=0.06mol/L,则K=5925.93; ⑷①相当于正逆速率相等,能说明该反应达到平衡状态;②气体密度会随平衡的移动而变化,不变时说明达平衡,能说明该反应达到平衡状态;③④⑤中的量永远为定值,不能说明该反应达到平衡状态;答案选①②; ⑸正极:N2+6e-+6H+=2NH3 负极:3H2-6e-=6H+ 整个计算用电子守恒,通过2molH+时则有1/3molN2参与反应,相当于(1/3)×(5/4)×22.4=9.33L空气。


科目:高中化学 来源: 题型:
【题目】用游离态的氮经一系列转化可制得硝酸,如下图所示。

(1)氨与氧气生成一氧化氮反应的化学方程式是______________。
(2)在800℃时,向容积为1L的密闭容器中充入0.020 mol NO和0.010 mol O2,发生反应2NO(g)+O2(g)![]() 2NO2(g),反应过程中O2的浓度随时间变化情况如下图所示。
2NO2(g),反应过程中O2的浓度随时间变化情况如下图所示。

①2min时,c(NO2)=_________mol/L。
②800℃时,该反应的化学平衡常数数值是__________。
③已知:

NO生成NO2热化学方程式是_________。为了提高NO的转化率可以采取的措施有__________。
(3)可用电解法处理含氮氧化物的废气。实验室模拟电解法吸收NO,装置如图所示(均为石墨电极)。电解过程中NO转化为硝酸的电极反应式是__________。若处理标准状况下448 L的NO,则可得到质量分数为63%的HNO3溶液的质量是____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是( )
A. 用浓盐酸分别和MnO2、KClO3反应制备1mol氯气,转移的电子数均为2NA
B. 1 mol H2O最多可形成4NA个氢键
C. 常温下,1L pH=2的H2SO4溶液中,硫酸和水电离的H+总数为0.01NA
D. 常温常压下,NO2与N2O4的混合气体46g,原子总数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某中学化学实验小组探究Na2O2能否与CO2反应生成O2,用如下的实验装置进行实验:(可供选用的反应物只有CaCO3固体、6 mol·L-1盐酸、6 mol·L-1硫酸和蒸馏水)
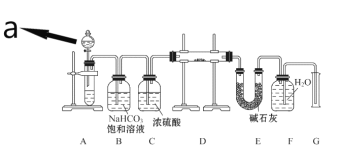
回答下列问题:
(1)仪器a的名称是____________,a中液体试剂应选用_____________(填“6 mol·L-1盐酸”或“6 mol·L-1硫酸”)。
(2)装置B的作用是______________,装置C的作用是_____________。
(3)装置D中发生反应的化学方程式是__________________________。
(4)装置E中碱石灰的作用是_________________________________。
(5)该实验装置中,如何证明Na2O2与CO2反应能否生成O2____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是( )
A. 5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28gN2,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28gN2,转移的电子数目为3.75NA
B. 室温下,0.2mol·L-1的Na2SO4溶液中含Na+数目为0.4NA
C. 标准状况下,NA个HF分子所占的体积约为22.4L
D. 高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2、NH4HSO4用途广泛。请回答下列问题:
(1)常温时,0.1 mol·L-1 NH4Al(SO4)2溶液的pH=3。则溶液中c(NH4+)+c(NH3·H2O)_______c (Al3+) + c[Al(OH)3](填“﹥”、“﹤”或“=”);2c(SO42-)- c(NH4+)-3c(Al3+)=________mol·L-1(填数值)。
(2)80℃时,0.1 mol·L-1 NH4Al(SO4)2溶液的pH小于3,分析导致pH随温度变化的原因是________________________ (用离子方程式并结合文字叙述回答)。
(3)常温时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加 0.1 mol·L-1 NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示。向NH4HSO4溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为__________________。
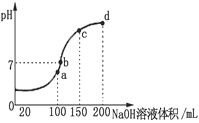
(4)浓度均为0.1 mol·L-1 NH4Al(SO4)2溶液和NH4HSO4溶液,其中______溶液c(NH4+)大。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】经检测某工厂的酸性废水中所含离子及其浓度如下表所示:
离子 | Fe3+ | Cu2+ | SO42- | Na+ | H+ |
浓度/(mol/L) | 2×10-3 | 1×10-3 | 1×10-2 | 2×10-3 |
(1)c(H+)= mol/L。
(2)为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾(FeSO4·7H2O)。

① 工业废水中加入铁粉后,反应的离子方程式为:
Fe + Cu2+ == Fe2+ + Cu、 、 。
② 试剂B是 。
③ 操作③是蒸发浓缩、冷却结晶、 ,最后用少量冷水洗涤晶体,在低温下干燥。
④ 通过检验溶液D中Fe3+来判断废水中Fe3+是否除尽,实验方法是 。
⑤ 获得的FeSO4·7H2O需密闭保存,原因是 。
⑥ 上述1000 L废水经处理,可获得 FeSO4·7H2O的物质的量是 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定盐酸、碳酸、硅酸的酸性强弱,设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质)。(提示:检验酸的酸性强弱可用强酸制取弱酸)

(1)锥形瓶中装某可溶性正盐,分液漏斗中所盛试剂应为________。
(2)装置B中所盛试剂是________________________________________,其作用是_____________。
(3)装置C中所盛试剂是___________________________________________,
C中反应的离子方程式是_________________________________________________。
(4)由此得到的结论是酸性:________>________>________。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,在“H2A—HA-—A2-”的水溶液体系中,H2A、HA-和A2- 三者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示。下列说法正确的是
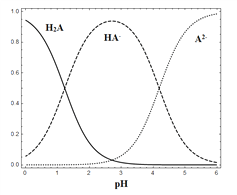
A. 在含H2A、HA-和A2- 的溶液中,加入少量NaOH固体,α(HA-)一定增大
B. 将等物质的量的NaHA和Na2A混合物溶于水,所得的溶液中α(HA-)=α(A2-)
C. NaHA溶液中,HA-的水解能力小于HA-的电离能力
D. 在含H2A、HA-和A2-的溶液中,若c(H2A)+2c(A2-)+c(OH-)=c(H+),则α(H2A)和α(HA-)一定相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com