
【题目】某实验小组利用如图装置制备 NH3 并探究其性质。下列说法正确的是

A.①中固体可换为 NH4Cl
B.②中药品为 P2O5
C.反应一段时间后,③中黑色固体变为红色
D.反应一段时间后,④中锥形瓶收集到液氨
 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
【题目】下列溶液中,Cl-的物质的量浓度最大的是( )
A.75mL4mol/L的KClO3溶液
B.50mLAl3+浓度为1mol/L的AlCl3溶液
C.9.5gMgCl2溶于水所配得的100mL溶液
D.1L密度为1.1g/cm3、质量分数为3.65%的HCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.我国的青海省有许多盐湖盛产食盐,人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用。粗盐中含Ca2+、Mg2+、SO42-以及泥沙等杂质,为了除去可溶性杂质,有以下实验步骤进行提纯:
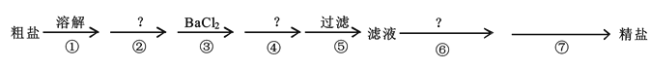
(1)④步所加试剂是____。
(2)第⑥步发生反应的离子方程式为____、____。
(3)第⑦步的操作名称____,需要的玻璃仪器有____、____。
(4)通过步骤⑤中过滤后的滤液,检验SO42-已除尽的操作方法是____。
Ⅱ.(1)设阿伏加德罗常数为NA,标准状况下,某O2和N2的混合气体m g含有b个分子,则n g该混合气体在相同状况下所占的体积是____L。
(2)在xR2++yH++O2═mR3++nH2O的离子方程式中,对化学计量数m和R2+、R3+判断正确的是____。
A.m=y,R3+是氧化产物 B.m=2y,R2+被氧化
C.m=2,R3+是氧化剂 D.m=4,R2+是还原剂
(3)用双线桥法标出下列反应的电子转移方向和数目____。2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,wg某物质在足量氧气中充分燃烧,其燃烧产物立即与过量的Na2O2反应,固体质量增加wg。在①H2;②CO;③CO和H2的混合物 ④甲醛(HCHO);⑤CH3COOH;⑥葡萄糖(C6H12O6)中,符合题意的是 ( )
A.均不符合B.只有①②③C.只有④⑤D.全部符合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】120mL含有0.20mol碳酸钠的溶液和200mL盐酸,不管将前者滴入后者,还是将后者滴入前者,都有气体产生,但最终生成的气体体积不同,且比值为5:2,则盐酸的浓度是( )
A.2.0mol/LB.1.0mol/LC.0.18mol/LD.1.25mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲基砜是合成人体胶原蛋白的必要物质。实验室用二甲基硫醚为原料合成二甲基砜的新方法为:
反应 i:(CH3)2S+H2O2→(CH3)2SO+H2O
反应 ii: 。
二甲基硫醚(CH3)2S | 二甲基亚枫(CH3)2SO | 二甲基砜(CH3)2SO2 | |
密度 | 0.85 g·cm-3 | 1.10 g·cm-3 | —— |
熔点/沸点 | -83.2℃/37.5℃ | 18.4℃/189℃ | 111℃/238℃ |
溶解性 | 不溶于水 | 易溶于水、乙醇 | 易溶于水、乙醇 |
具体流程如下:
![]()
回答下列问题:
(1)反应装置如图所示,仪器 B 的名称是_____,其作用是_____。
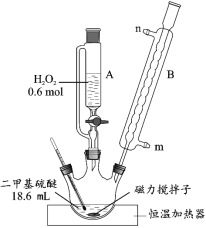
(2)第①步反应温度不高于 40 ℃的原因是_____;该步骤反应完全的现象是_____。
(3)第②步先将 A 中滴加剩余的 H2O2 全部加入三颈烧瓶中,然后加热发生反应 ii。该反应的化学方程式为_____。
(4)第③步的实验操作为_____、过滤、低温干燥,得到二甲基砜产品。
(5)二甲基砜传统的生产工艺是由 HNO3 氧化(CH3)2S 生成(CH3)2SO,然后用 NaOH 中和、精馏,制得精品(CH3)2SO,最后再经氧化制得(CH3)2SO2。该新方法与传统硝酸氧化法比的优点有_____(至少回答 2 点)。
(6)该实验中制得二甲基砜 19.176g。二甲基砜的产率为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是一些烷烃的燃烧热,则下列表达正确的是
化合物 | 燃烧热/ kJ·mol-1 | 化合物 | 燃烧热/ kJ·mol-1 |
甲烷 | 891.0 | 正丁烷 | 2878.0 |
乙烷 | 1560.8 | 异丁烷 | 2869.6 |
丙烷 | 2221.5 | 异戊烷 | 3531.3 |
A. 正戊烷的燃烧热大于3531.3 kJ·mol-1
B. 相同质量的烷烃、碳的质量分数越大,燃烧放出的热量越多
C. 正丁烷转化为异丁烷的热化学方程式为:CH3CH2CH2CH3(g) ![]() CH3CH(CH3)CH3(g) △H =+8.4kJ·mol-1
CH3CH(CH3)CH3(g) △H =+8.4kJ·mol-1
D. 甲烷燃烧的热化学方程式为:CH4(g)+2O2(g) ![]() CO2(g) +2H2O(g) △H =-891.0kJ·mol-1
CO2(g) +2H2O(g) △H =-891.0kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】降冰片烯(结构见 F)的衍生物在橡胶工业有重要用途。一种利用脱羰偶联反应合成其衍生物的路线如下:
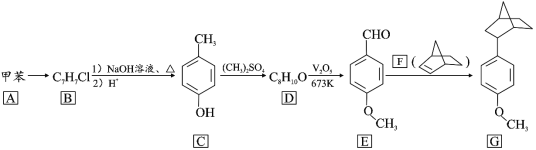
回答下列问题
(1)A→B 所需的试剂为_______________ 。
(2)B→C 第一步反应的化学方程式为_____。
(3)D 的结构简式为_____,C→D 的反应类型为_______。
(4)E 中的官能团名称为_____。
(5)芳香化合物X 是E 的同分异构体,X 能与热的NaOH 溶液反应生成稳定化合物, 0.1mol X 消耗 NaOH 0.2mol,化合物 X 共有_____种(不考虑立体异构)。其中核磁共振氢谱显示有 5 种不同化学环境的氢,峰面积比为 2∶2∶2∶1∶1 的结构简式为_____。
(6)参照上述路线,设计由苯甲醛、甲醇和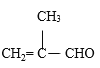 制备成
制备成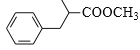 路线_____。(无机试剂任选)
路线_____。(无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型高性能电池的开发与研究已成为当下信息产业化时代的迫切要求、某研究团队设计研制了种高性能的磷酸铁锂(LiFePO4,简称LFP)电池。正极材料为磷酸铁锂,与Al相连,负极材料为石墨,与Cu相连,正、负之间存在电解质并通过聚合物隔膜隔开,此膜只允许Li+通过,其工作原理如图所示,总反应为Li(1-x)C6十LiFePO4![]() LiC6+ Li(1-x) FePO4。下列有关说法正确的是
LiC6+ Li(1-x) FePO4。下列有关说法正确的是
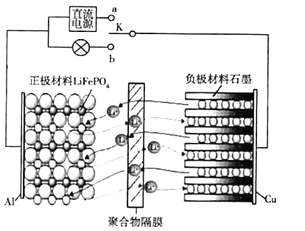
A.当开关K置于a时,Li+由右向左穿过聚合物隔膜到达正极
B.当开关K置于a时,正极材料上的电极反应为: Li(1-x) FePO4 +xLi ++xe- =LiFePO4
C.该电池的正、负极之间可以用Na2SO4水溶液作电解质溶液
D.当开关K置于b时,负极上的电极反应为:LiC6- xe- = Li(1-x) C6+xLi+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com