
| 实验编号 | 1 | 2 | 3 | 4 |
| c(CH3COCH3)/mol•L-1 | 2.500 | 2.500 | 1.250 | 2.500 |
| c(HCl)/mol•L-1 | 0.500 | 1.000 | 1.000 | 1.000 |
| c(I2)/mol•L-1 | 0.010 | 0.010 | 0.010 | 0.020 |
| v(I2)/10-6 mol•L-1•s-1 | 1.500 | 3.000 | 1.498 | 3.000 |
| A. | I2的起始浓度越大,反应速率越大 | |
| B. | 该反应中HCl是催化剂,c(HCl)的改变不会影响反应速率 | |
| C. | 实验2与实验4两组实验的实验时间相等 | |
| D. | v(I2)/[c(CH3COCH3)•c(HCl)]为常数 |
分析 A、对比②④组数据,可以判断出增大c(I2),v(I2)不变;
B、比较实验①和②数据,c(HCl)越大,v(I2)越大;
C、对比②④组数据,v(I2)相等,但c(I2)不等来判断时间;
D、将①②③④实验中数据代人计算v(I2)/[c(CH3COCH3)•c(HCl)].
解答 解:A、对比②④组数据,可以判断出增大c(I2),v(I2)不变,故A错误;
B、比较实验①和②数据,c(HCl)越大,v(I2)越大,故B错误;
C、对比②④组数据,v(I2)相等,但c(I2)不等,所以实验2与实验4两组实验的实验时间不相等,故C错误;
D、将①②③④实验中数据代人计算v(I2)/[c(CH3COCH3)•c(HCl)]是相同的,所以v(I2)/[c(CH3COCH3)•c(HCl)]为常数,故D正确;
故选D.
点评 本题考查化学反应速率及其影响因素,做题时注意加强对表中数据的比较和分析,不难得出结论.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,18g(H218O)含有的原子总数为3NA | |
| B. | 标准状况下,4.2g CH2=CH2气体中所含有的碳原子总数为0.3NA | |
| C. | 将0.1mol的Cl2通入1L水中转移的电子数目为0.1NA | |
| D. | 0.1mol/LAl2(SO4)3溶液中含有的Al3+总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
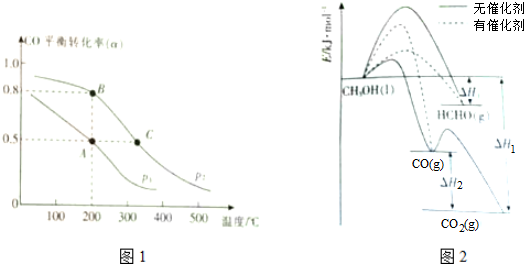
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶格能大小:NaI>NaBr>NaCl>NaF | B. | 单质的熔点:Li<Na<K<Rb | ||
| C. | 共价键的键能:C-C>C-Si>Si-Si | D. | 沸点高低:HF<HCl<HBr<HI |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C的燃烧热为Q1 kJ/mol | |
| B. | 2 mol CO(g)所具有的能量一定高于2 mol CO2(g)所具有的能量 | |
| C. | 一定质量的C燃烧,生成CO2(g)比生成CO(g)时放出的热量多 | |
| D. | C燃烧生成CO2气体的热化学方程式为:C(s)+O2(g)═CO2(g)△H=-(Q1+Q2) kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com