
【题目】用下列实验装置进行的实验,能达到相应实验目的的是( )
A.图2:收集NO2气体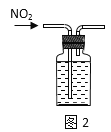
B.图3:验证X溶液为浓硝酸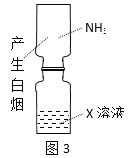
C.图4:验证氨气在水中的溶解性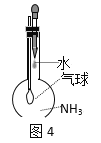
D.图5:用于吸收尾气NH3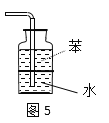
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】以NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.36g冰(图甲)中含共价键数目为4NA
B.12g金刚石(图乙)中含有σ键数目为4NA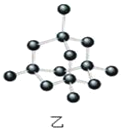
C.44g干冰(图丙)中含有NA个晶胞结构单元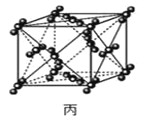
D.12g石墨(图丁)中含σ键数目3NA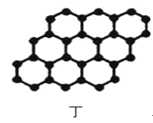
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示一些晶体中的某些结构,请回答下列问题:
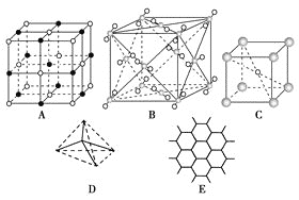
(1)代表金刚石的是(填编号字母,下同)___,其中每个碳原子与____个碳原子最近且距离相等。金刚石属于____晶体。
(2)代表石墨的是____,每个正六边形占有的碳原子数平均为____个。
(3)代表NaCl的是___,每个Na+周围与它最近且距离相等的Na+有___个,每个Na+周围与它最近且距离相等的Cl-有___个。
(4)代表CsCl的是___,它属于____晶体,每个Cs+与____个Cl-紧邻。
(5)代表干冰的是___,它属于___晶体,每个CO2分子与___个CO2分子紧邻。
(6)已知石墨中碳碳键的键长比金刚石中碳碳键的键长短,则上述五种物质熔点由高到低的排列顺序为____(用名称回答)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。
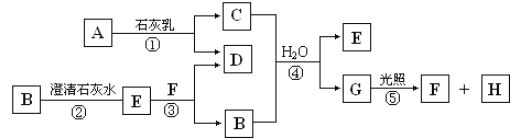
请回答以下问题:
(1)工业上常利用反应①制取漂白粉,该反应的化学方程式:_____,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为____。
(2)A中元素的原子结构示意图为____。
(3)F在溶液中的电离方程式为_____。
(4)上述反应中属于氧化还原反应的是___(填写序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟合成硫酸的流程如下:

从下图中选择制取气体的合适装置:

(1)装置C的名称为__________,实验室通常用装置C制备_____。
A.H2 B.C2H2 C.CO2 D.NH3
(2)实验室用装置D制备O2的化学方程式为____________________。
(3)若用装置B制备SO2,可以选用试剂为_____。
A.浓硫酸、亚硫酸钠固体 B.浓硫酸、铜片
C.稀硫酸、亚硫酸钠溶液 D.浓硫酸、铁屑
(4)SO2和O2通过甲装置,甲装置的作用除了可以控制SO2、O2的流速外,还可以__________、__________。

(5)使用乙处导出的有关气体制成硫酸,下列a、b、c三套装置中你选择的是_______,该套装置与其它装置比较,其优点是___________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图是某种有机物分子的球棍模型图。图中的“棍”代表单键或双键,不同大小的“球”代表三种不同的短周期元素的原子。对该有机物的叙述不正确的是( )

A.该有机物可能的分子式为C2HCl3
B.该有机物的分子中一定有![]()
C.该有机物分子中的所有原子在同一平面上
D.该有机物可以由乙烯和氯化氢加成反应得到
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应。
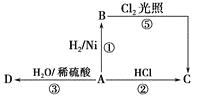
据图回答下列问题:
(1)写出A、C、D的结构简式:
A________,C________,D________。
(2)写出①②两步反应的化学方程式,并注明反应类型:
①________________________________(反应类型____________)。
②________________________________(反应类型____________)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳热还原氯化法从铝土矿中炼铝具有步骤简单、原料利用率高等优点,其原理如下:
Ⅰ.Al2O3(s) + AlCl3(g) + 3C(s) ![]() 3AlCl(g) + 3CO(g) – 1486 kJ
3AlCl(g) + 3CO(g) – 1486 kJ
Ⅱ.3AlCl(g) ![]() 2Al(l) + AlCl3(g) + 140 kJ
2Al(l) + AlCl3(g) + 140 kJ
(1)写出反应Ⅰ的化学平衡常数表达式K=_____________,升高温度,K_______(填增大、减小、不变)。
(2)写出反应Ⅱ达到平衡状态的一个标志_________________________________;结合反应Ⅰ、Ⅱ进行分析,AlCl3在炼铝过程中的作用可以看作___________。
(3)将1mol氧化铝与3mol焦炭的混合物加入2L反应容器中,加入2mol AlCl3气体,在高温下发生反应Ⅰ。若5min后气体总质量增加了27.6g,则AlCl的化学反应速率为_________ mol/(L·min)。
(4)Na2O2具有很强的氧化性。少量Na2O2与FeCl2溶液能发生反应:____Na2O2+ FeCl2+___H2O→____Fe(OH)3↓+_____FeCl3+____NaCl;已知FeCl2前面系数为6,配平上述化学方程式,并标出电子转移方向和数目________________。此反应中被还原的元素是____________,氧化产物是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铝土矿(成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的工艺流程如下:
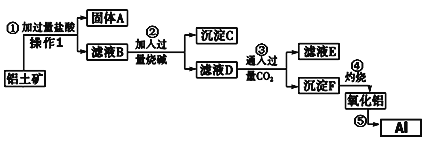
则回答下列问题:
(1)操作1的名称为____________,用到的玻璃仪器除玻璃棒、烧杯外,还需_________;
(2)沉淀C的成分为________________(写化学式);
(3)设计最简实验证明滤液D中Fe3+已沉淀完全(写出操作、现象及结论,试剂任选):取2mL滤液D于试管中,__________________________。
(4)滤液E中的主要溶质的化学式为________________;
(5)写出步骤⑤的化学方程式________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com