
| A. | Ksp只与难溶电解质的性质和温度有关 | |
| B. | 由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀 | |
| C. | 难溶电解质Mg(OH)2的Ksp=c( Mg2+)•c(OH-) | |
| D. | 25℃,Ksp(AgCl)=1.8×10-10,则AgCl饱和水溶液体系中c(Ag+)为$\sqrt{1.8}$×10-5mol/L |
分析 A.化学反应平衡常数只与反应本身的性质和温度有关,与溶液中离子浓度无关;
B.从难溶电解质的溶解平衡的角度分析;
C.溶度积等于离子的浓度幂之积;
D.根据Ksp=c(Ag+)×c(Cl-)计算.
解答 解:A.化学反应平衡常数只与反应本身的性质和温度有关,当难溶物确定时就只和温度有关了,故A正确;
B.由于Ksp(ZnS)>Ksp(CuS),在ZnS饱和溶液中加入Cu2+溶液,可生成CuS沉淀,故B正确;
C.难溶电解质Mg(OH)2的Ksp=c( Mg2+)•c2(OH-),故C错误;
D.c(Ag+)×c(Cl-)=1.8×10-10,且氯化银溶液中c(Ag+)=c(Cl-),则c(Ag+)为$\sqrt{1.8}$×10-5mol/L,故D正确.
故选C.
点评 本题考查难溶电解质的溶解平衡,为高频考点,侧重于平衡常数的含义与应用的理解,题目难度不大,答题时注意把握溶度积的表达式.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | Cl2是还原产物 | |
| B. | □处对应的物质为H2O | |
| C. | 氧化剂与还原剂物质的量之比为1:8 | |
| D. | 若1mol KMnO4参加反应,转移的电子的物质的量是4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
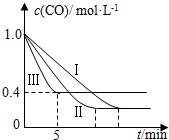 利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.
利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.| 编号 | 温度 | 压强 | c始(CO) | c始(H2O) |
| Ⅰ | 530℃ | 3MPa | 1.0mol•L-1 | 3.0mol•L-1 |
| Ⅱ | X | Y | 1.0mol•L-1 | 3.0mol•L-1 |
| Ⅲ | 630℃ | 5MPa | 1.0mol•L-1 | 3.0mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
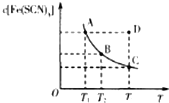 已知:FeCl3(aq)+3KSCN(aq)?3KCl(aq)+Fe(SCN)3(aq),平衡时Fe(SCN)3的物质的量浓度与温度T的关系如图所示,则下列说法正确的是( )
已知:FeCl3(aq)+3KSCN(aq)?3KCl(aq)+Fe(SCN)3(aq),平衡时Fe(SCN)3的物质的量浓度与温度T的关系如图所示,则下列说法正确的是( )| A. | A点与B点相比,A点的血红色沉淀更多 | |
| B. | 加入KCl固体可以使溶液由D点变到C点 | |
| C. | 反应处于D点时,一定有V(正)<V(逆) | |
| D. | 若T1、T2温度下的平衡常数分别为K1、K2,K1<K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二氧化硫和氮的氧化物是常用的工业原料,但也是大气的主要污染物.综合治理其污染是环境化学当前的重要研究内容之一.
二氧化硫和氮的氧化物是常用的工业原料,但也是大气的主要污染物.综合治理其污染是环境化学当前的重要研究内容之一.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com