
分析 碳酸氢钠不稳定,加热易分解,生成碳酸钠、水和二氧化碳,鉴别碳酸钠和碳酸氢钠的溶液,可加入氯化钙溶液,碳酸钠与氯化钙反应生成碳酸钙沉淀,碳酸氢钠不反应,以此解答该题.
解答 解:碳酸氢钠不稳定,加热易分解,生成碳酸钠、水和二氧化碳,反应的化学方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,鉴别碳酸钠和碳酸氢钠的溶液,可加入氯化钙溶液,碳酸钠与氯化钙反应生成碳酸钙沉淀,反应的离子方程式为Ca2++CO32-=CaCO3↓,碳酸氢钠不反应,
故答案为:NaHCO3;2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;Ca2++CO32-=CaCO3↓.
点评 本题考查碳酸钠和碳酸氢钠等知识,为高频考点,侧重考查学生对双基知识的掌握,难度不大,注意碳酸氢钠的不稳定性以及鉴别二者的方法.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:选择题
| A. | 水煤气只能用作燃料 | |
| B. | 水煤气是一种二级能源,比煤直接燃烧污染小 | |
| C. | 等质量的CO和H2完全燃烧时,前者放热多 | |
| D. | 由③反应可以确定H2的燃烧热为241.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
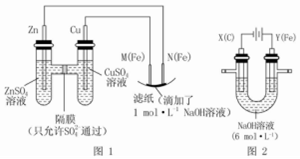 某课外小组分别用如图所示装置对原电池和电解原理进行实验探究.
某课外小组分别用如图所示装置对原电池和电解原理进行实验探究.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | N4和N2是氮元素的两种不同单质 | |
| B. | ${\;}_{7}^{14}{N}_{4}$、${\;}_{7}^{15}{N}_{2}$互为同位素 | |
| C. | 相同质量的N4和N2所含原子个数比为1:2 | |
| D. | ${\;}_{7}^{14}{N}_{4}$的摩尔质量是56g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 浓硫酸(98%)的物质的量浓度 | B. | 常温下氯化钠的溶解度 | ||
| C. | 标准状况下气体摩尔体积 | D. | 0.2g金刚石所含的C原子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按分散系中分散质粒子的大小可以把分散系分为溶液、胶体和浊液 | |
| B. | 氧化还原反应的本质是化合价的升降 | |
| C. | 金属的硬度都比较大,不能用刀切 | |
| D. | 氯气常用做自来水的净水剂,原因是氯气无毒,对人体无害 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 23 g Na与足量H2O反应完全后可生成NA个H2分子 | |
| B. | 1 mol Cu和足量热浓硫酸反应可生成NA个SO3分子 | |
| C. | 标准状况下,22.4 L Cl2含NA个原子 | |
| D. | 3 mol单质Fe完全转变为Fe3O4,失去8 NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
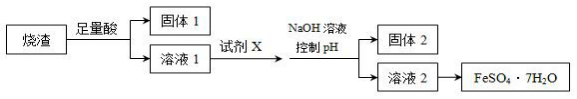
| A. | 溶解烧渣选用足量硫酸,试剂X选用铁粉 | |
| B. | 固体1中一定含有SiO2,控制pH为使Al3+转化为Al(OH)3,进入固体2 | |
| C. | 从溶液2得到FeSO4•7H2O产品的过程中,须控制条件防止其氧化 | |
| D. | 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4•7H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
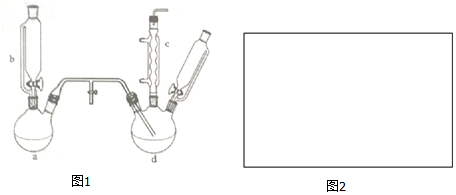
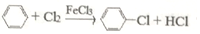 .
.| 项目 | 二氯苯 | 氯化尾气 | 蒸气 | 成品 | 不确定苯耗 | 合计 |
| 苯流失量(t/kg) | 11.7 | 5.4 | 20.8 | 2.0 | 49.3 | 89.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com