
(15分)(一)尿素又称碳酰胺,是含氮量最高的氮肥,工业上利用二氧化碳和氨气在一定条件下合成尿素。其反应分为如下两步:
第一步:2NH3(l)+CO2(g)  H2NCOONH4(氨基甲酸铵) (l) △H1= -330.0 kJ·mol-1
H2NCOONH4(氨基甲酸铵) (l) △H1= -330.0 kJ·mol-1
第二步:H2NCOONH4(l)  H2O(l)+H2NCONH2(l) △H2= + 226.3 kJ·mol-1
H2O(l)+H2NCONH2(l) △H2= + 226.3 kJ·mol-1
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 m3 密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如下图所示:

①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 步反应决定。
②反应进行到10 min时测得CO2的物质的量如上图所示,则用CO2表示的第一步反应的速率v(CO2)= mol/(L·min)。
③当反应在一定条件下达到平衡,若在恒温、恒容下再充入一定量气体He,则CO(NH2)2(l)的质量_______(填“增加”、“减小”或“不变”)。
(二)氨是制备尿素的原料,氨气溶于水得到氨水,在25℃下,将a mol/L的氨水与b mol/L的硫酸以3∶2体积比混合反应后溶液呈中性。用含a和b的代数式表示出氨水的电离平衡常数为_________。此溶液中各离子浓度由大到小的顺序为_________。
(三)氢气是合成氨的原料。“氢能”将是未来最理想的新能源。
(1)在25℃,101KPa条件下,1 g氢气完全燃烧生成液态水时放出142.9kJ热量,则表示氢气燃烧热的热化学方程式为 。
(2)氢气通常用生产水煤气的方法制得。其中C(s)+ H2O(g)  CO(g)+H2(g),在850℃时平衡常数K=1。若向1升的恒定密闭真空容器中同时加入x mol C和6.0mol H2O。
CO(g)+H2(g),在850℃时平衡常数K=1。若向1升的恒定密闭真空容器中同时加入x mol C和6.0mol H2O。
①当加热到850℃反应达到平衡的标志有______________ 。
A.容器内的压强不变
B.消耗水蒸气的物质的量与生成CO的物质的量相等
C.混合气的密度不变
D.单位时间有n个H—O键断裂的同时有n个H—H键断裂
②x应满足的条件是 。
(15分,第(一)问①1分,其余每空2分)
(一)①二 ②1.5×10-4 ③不变
(二)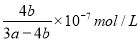 c(NH4+)>c(SO42-)>c(H+)=c(OH-)
c(NH4+)>c(SO42-)>c(H+)=c(OH-)
(三)(1)H2(g) +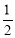 O2(g)=H2O(l) △H=-285.8 KJ/mol
O2(g)=H2O(l) △H=-285.8 KJ/mol
(2)①AC ②x>2
【解析】
试题分析:(一)①通过各组分的物质的量随时间变化关系图可知第二步反应较慢,总反应的反映速率由第二步决定;②V=0.50m3=500L,反应进行到10 min时测得CO2的物质的量是0.25mol,所以用CO2表示反应速率是V(CO2)=(1-0.25)mol÷500L÷10min=1. 5×10-4mol/(Lmin);③当反应在一定条件下达到平衡,若在恒温、恒容下再充入一定量气体He,气体的浓度不变,则平衡不发生移动,CO(NH2)2(l)的质量不变;(二)氨是制备尿素的原料,氨气溶于水得到氨水,在25℃下,将a mol/L的氨水与b mol/L的硫酸以3∶2体积比混合反应后溶液呈中性。n(NH3)=3amol;n(H+)=4bmol;NH3+H+=NH4+;根据电荷守恒可得n(H+)+n(NH4+)=n(OH-)+2n(SO42-),由于混合反应后溶液呈中性所以n(H+)= n(OH-)。故n(NH4+)= 2n(SO42-)=2×2b=4bmol;c(NH4+)=4bmol则在溶液中用含a和b的代数式表示出氨水的电离平衡常数为K=[(4b÷5)mol/L ×10-7mol/L]÷[(3a-4b) ÷5 mol/L]=4b×10-7/(3-4b)mol/L。此溶液中各离子浓度由大到小的顺序为c(NH4+)>c(SO42-)>c(H+)=c(OH-);(三)(1)在25℃,101KPa条件下,1 g氢气完全燃烧生成液态水时放出142.9kJ热量,则表示氢气燃烧热的热化学方程式为H2(g) +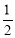 O2(g)=H2O(l)△H=-285.8 KJ/mol;(2)氢气通常用生产水煤气的方法制得。其中C(s)+ H2O(g)
O2(g)=H2O(l)△H=-285.8 KJ/mol;(2)氢气通常用生产水煤气的方法制得。其中C(s)+ H2O(g)  CO(g)+H2(g),在850℃时平衡常数K=1。若向1升的恒定密闭真空容器中同时加入x mol C和6.0mol H2O。①A.由于该反应是反应前后气体体积不等的反应,若前后气体容器内的压强不变,则气体的物质的量不变,反应达到平衡,正确; B.在任何时刻都存在消耗水蒸气的物质的量与生成CO的物质的量相等 ,因此不能作为判断平衡的标志,错误;C.由于该反应是反应前后气体的质量改变的反应,若气体的混合气的密度不变,则反应处于平衡状态,正确;D.单位时间有2n个H—O键断裂的同时有n个H—H键断裂,则反应处于平衡状态,现在单位时间有n个H—O键断裂的同时有n个H—H键断裂,反应未达到平衡状态,错误;②运用三段式处理。假设反应过程中H2O 改变的浓度是amol/L,则产生的CO、H2的浓度也是amol/L,平衡时H2O的浓度是(6-a)mol/L,K=c(CO)c(H2)÷c(H2O)=a2÷(6-a)=1,解得a=2,由于可逆反应反应物不能完全转化为生成物,所以x应满足的条件是x>2。
CO(g)+H2(g),在850℃时平衡常数K=1。若向1升的恒定密闭真空容器中同时加入x mol C和6.0mol H2O。①A.由于该反应是反应前后气体体积不等的反应,若前后气体容器内的压强不变,则气体的物质的量不变,反应达到平衡,正确; B.在任何时刻都存在消耗水蒸气的物质的量与生成CO的物质的量相等 ,因此不能作为判断平衡的标志,错误;C.由于该反应是反应前后气体的质量改变的反应,若气体的混合气的密度不变,则反应处于平衡状态,正确;D.单位时间有2n个H—O键断裂的同时有n个H—H键断裂,则反应处于平衡状态,现在单位时间有n个H—O键断裂的同时有n个H—H键断裂,反应未达到平衡状态,错误;②运用三段式处理。假设反应过程中H2O 改变的浓度是amol/L,则产生的CO、H2的浓度也是amol/L,平衡时H2O的浓度是(6-a)mol/L,K=c(CO)c(H2)÷c(H2O)=a2÷(6-a)=1,解得a=2,由于可逆反应反应物不能完全转化为生成物,所以x应满足的条件是x>2。
考点:考查化学反应速率的计算、弱电解质电离平衡常数的计算、微粒浓度的大小比较、热化学方程式的书写、平衡状态的判断、物质的加入量的计算的知识。


科目:高中化学 来源:2014-2015学年山东省菏泽市高三上学期期末考试化学B试卷(解析版) 题型:选择题
短周期主族元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为14。Y和Z位于同一周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的2倍。下列说法不正确的是
A.X的氢化物溶液与其最高价氧化物对应的水化物溶液的酸碱性相反
B.Y的氧化物既可与强酸反应又可与强碱反应,并可用来制作耐火材料
C.X和Y的最高价氧化物对应的水化物都是强酸
D.Z的氢化物与X的氢化物能够发生化学反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市姜堰区高三下学期期初联考化学试卷(解析版) 题型:选择题
25 ℃时,下列溶液中微粒的物质的量浓度关系正确的是
A.Na2CO3溶液:c(OH-)-c(H+)=c(HCO3-)+ 2c(H2CO3)
B.浓度均为0.1 mol·L-1的CH3COOH和CH3COONa混合液(pH<7):c(CH3COOH)>c(CH3COO-)>c (Na+)>c(H+)>c(OH-)
C.浓度均为0.1 mol·L-1的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+ c(H2CO3)
D.向0.1 mol/L NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c (OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省五市十校高三下学期3月模拟考试理综化学试卷(解析版) 题型:填空题
(15分)能源、环境与人类生活和社会发展密切相关,研究它们的综合利用有重要意义。
(1)氧化—还原法消除氮氧化物的转化如下: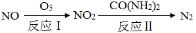
①反应Ⅰ为:NO+O3=NO2+O2,生成11.2 L O2(标准状况)时,转移电子的物质的量是 mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,反应的化学方程式是 。
(2)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:NO2(g)+SO2(g) SO3(g)+NO(g) △H=-41.8 kJ·mol-1已知:2SO2(g)+O2(g)
SO3(g)+NO(g) △H=-41.8 kJ·mol-1已知:2SO2(g)+O2(g) 2SO3(g) △H=-196.6 kJ·mol-1写出NO和O2反应生成NO2的热化学方程式 。
2SO3(g) △H=-196.6 kJ·mol-1写出NO和O2反应生成NO2的热化学方程式 。
(3)某化学兴趣小组构想将NO转化为HNO3,装置如下图,电极为多孔惰性材料。则负极的电极反应式是 。

(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g);
CH3OCH3(g)+3H2O(g);
①该反应平衡常数表达式为K= 。
②已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如图所示。该反应的ΔH________(填“>”、“<”或“=”)0。

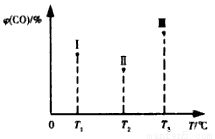
(5)合成气CO和H2在一定条件下能发生如下反应:CO(g) +2H2(g) CH3OH(g) △H<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是 ;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是 。
CH3OH(g) △H<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是 ;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省五市十校高三下学期3月模拟考试理综化学试卷(解析版) 题型:选择题
下列叙述错误的是
A.在加热搅拌条件下加入MgO,可除去MgCl2溶液中的Fe3+
B.pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍
C.常温下,CH3COONa和CH3COOH的混合溶液中(pH=7):c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-)
D.常温下,Cd(OH)2和Co(OH)2的混合悬浊液中,c(Cd2+)是c(Co2+)的3.5倍,已知:KSP(Cd(OH)2)=7.2×10-15, KSP(Co(OH)2)=1.8×10-15
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省仙桃天门潜江高三上学期期末联考理综化学试卷(解析版) 题型:选择题
下列实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向盛有Fe(NO3)2溶液的试管 中加入0.1mol/L H2SO4溶液 | 试管口出现红棕色 气体 | 溶液中NO3—被 Fe2+还原为NO2 |
B | 向饱和Na2CO3溶液中通入足 量CO2 | 溶液变浑浊 | 析出Na2CO3晶体 |
C | 等体积pH=2的HX和HY两 种酸分别与足量的铁反应,排 水法收集气体 | HX放出的氢气多且 反应速率快 | HX酸性比HY弱 |
D | 先向2mL0.1mol/LNa2S溶液中 滴几滴0.1mol/LZnSO4溶液,再 加入几滴0.1mol/LCuSO4溶液 | 开始有白色沉淀生成;后又有黑色沉淀生成 | Ksp(ZnS)<Ksp(CuS) |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省八市高三年级三月联考理综化学试卷(解析版) 题型:实验题
选考【化学——选修2:化学与技术】(15分)
将海水淡化与浓海水资源化结合起来是综合利用海水的重要途径之一。一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺流程提取其他产品。
回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是________(填序号)。
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾、溴、镁等的提取工艺
(2)采用“空气吹出法”从浓海水吹出Br2,并用纯碱吸收。溴歧化为Br-和BrO3-并没有产生CO2则反应的离子反应方程式为 。
(3)海水提镁的一段工艺流程如下图:
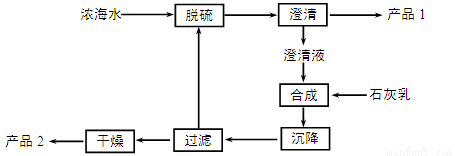
浓海水的主要成分如下:
离子 | Na+ | Mg2+ | Cl- | SO42- |
浓度/(g·L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
该工艺过程中,脱硫阶段主要反应的阳离子_____,获得产品2的离子反应方程式为 ,浓海水的利用率为90%,则1L浓海水最多可得到产品2的质量为________g。
(4)由MgCl2·6H2O制备MgCl2时,往往在HCl的气体氛围中加热。其目的是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省肇庆市高一上学期期末考试化学试卷(解析版) 题型:选择题
2007年诺贝尔化学奖授予善于做“表面文章”的德国科学家格哈德·埃特尔。他的成就之一是证实了气体在固体催化剂表面进行的反应,开创了表面化学的方法论。在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示。下列说法正确的是

A.NO2是该过程的中间产物
B.NO和O2必须在催化剂表面才能反应
C.汽车尾气的主要污染成分是CO2和NO
D.该催化转化的总反应方程式为:2NO +O2 +4CO 4CO2+N2
4CO2+N2
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省广州市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列关于物质的类别的说法不正确的是
A.能在水溶液或熔融状态下导电的物质就是电解质
B.胶体是一种能产生丁达尔效应的分散系
C.纯碱不属于碱,干冰属于酸性氧化物
D.Na2O和Na2O2都能与水反应生成对应的碱,它们都是碱性氧化物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com