
| H2SO4溶液 | KMnO4溶液 | H2C2O4溶液 | 褪色时间(分:秒) |
| 1mL 2mol/L | 2mL 0.01mol/L | 1mL 0.1mol/L | 2:03 |
| 1mL 2mol/L | 2mL 0.01mol/L | 1mL 0.2mol/L | 2:16 |
| a | KMnO4与H2C2O4反应是分步进行的,反应过程中生成Mn(VI)、Mn(III)、Mn(IV),最终变为无色的Mn(II).(括号中罗马数字表示锰的化合价) |
| b | 草酸根易与不同价态锰离子形成较稳定的配位化合物. |
| c | 草酸稳定性较差,加热至185℃可分解. |
| H2SO4溶液 | Na2SO4固体 | KMnO4溶液 | H2C2O4溶液 | 褪色时间(分:秒) |
| 1mL 0.1mol/L | 1.9×10-3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 16:20 |
| 1mL 0.5mol/L | 1.5×10-3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 8:25 |
| 1mL 1.0mol/L | 1.0×10-3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 6:15 |
| 1mL 2.0mol/L | 0 | 2mL 0.01mol/L | 1mL 0.2mol/L | 2:16 |
分析 (1)酸性条件下高锰酸根离子和草酸根离子发生氧化还原反应,根据元素守恒知,生成物中生成水,该反应中Mn元素化合价由+7价变为+2价、C元素化合价由+3价变为+4价,根据转移电子守恒、原子守恒配平方程式;
(2)据表格数据进行分析;
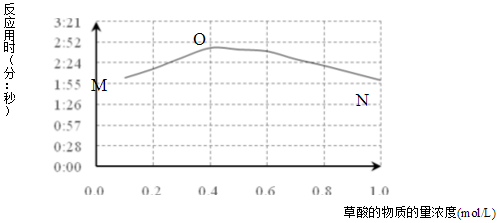
(3)①图象描述的是当草酸浓度小于0.4mol/L时,反应速率随着草酸浓度增加而减小,当草酸浓度大于0.4mol/L时,反应速率随着草酸浓度增加而增加,据此进行分析;
②据MO变化趋势,得出反应速率随着草酸浓度增加而减小,可能原因是KMnO4与H2C2O4反应是分步进行的,反应过程中生成Mn(VI)、Mn(III)、Mn(IV),最终变为无色的Mn(II),以及草酸根易与不同价态锰离子形成较稳定的配位化合物,据此进行分析;
(4)小组进行实验III的目的是探究其他离子浓度不变,溶液中H+浓度对反应速率的影响;
(5)当草酸浓度较小时,C2O42-起主要作用,草酸浓度越大,反应速率越小;当草酸浓度较大时,H+起主要作用,使得草酸浓度越大,反应速率越大.
为验证C2O42-对反应速率的影响,保持高锰酸钾与硫酸溶液浓度不变,增加草酸钠的浓度,记录反应速率;若随着草酸钠浓度增加,反应速率降低;证明C2O42-浓度越大,反应速率越小(实验方案包括:目的,操作,现象,结论),据此进行分析.
解答 解:(1)酸性条件下高锰酸根离子和草酸根离子发生氧化还原反应,根据元素守恒知,生成物中生成水,该反应中Mn元素化合价由+7价变为+2价、C元素化合价由+3价变为+4价,转移电子数为10,根据转移电子守恒、原子守恒配平方程式得2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O,
故答案为:5;16 H+; 10; 8;
(2)在当前实验条件下,当高锰酸钾一定时,增大草酸浓度,反应时间延长,故得到的结论是在当前实验条件下,增大草酸浓度,反应速率减小,
故答案为:在当前实验条件下,增大草酸浓度,反应速率减小;
(3)①当草酸浓度小于0.4mol/L时,反应速率随着草酸浓度增加而减小,当草酸浓度大于0.4mol/L时,反应速率随着草酸浓度增加而增加,
故答案为:当草酸浓度小于0.4mol/L时,反应速率随着草酸浓度增加而减小,当草酸浓度大于0.4mol/L时,反应速率随着草酸浓度增加而增加;
②MO变化趋势,得出反应速率随着草酸浓度增加而减小,可能原因是KMnO4与H2C2O4反应是分步进行的,反应过程中生成Mn(VI)、Mn(III)、Mn(IV),最终变为无色的Mn(II),以及草酸根易与不同价态锰离子形成较稳定的配位化合物,
故答案为:ab;
(4)小组进行实验III的目的是探究其他离子浓度不变,溶液中H+浓度对反应速率的影响,
故答案为:探究其他离子浓度不变,溶液中H+浓度对反应速率的影响;
(5)实验方案进行理论设计如下:当草酸浓度较小时,C2O42-起主要作用,草酸浓度越大,反应速率越小;当草酸浓度较大时,H+起主要作用,使得草酸浓度越大,反应速率越大.
为验证C2O42-对反应速率的影响,保持高锰酸钾与硫酸溶液浓度不变,增加草酸钠的浓度,记录反应速率;若随着草酸钠浓度增加,反应速率降低;证明C2O42-浓度越大,反应速率越小(实验方案包括:目的,操作,现象,结论),
答:当草酸浓度较小时,C2O42-起主要作用,草酸浓度越大,反应速率越小;当草酸浓度较大时,H+起主要作用,使得草酸浓度越大,反应速率越大.
为验证C2O42-对反应速率的影响,保持高锰酸钾与硫酸溶液浓度不变,增加草酸钠的浓度,记录反应速率;若随着草酸钠浓度增加,反应速率降低;证明C2O42-浓度越大,反应速率越小(实验方案包括:目的,操作,现象,结论).
点评 本题考查离子方程式的书写,探究影响化学反应速率的因素,着重考查学生看图及分析数据的能力,本题难度中等.


科目:高中化学 来源: 题型:选择题

| A. | 催化液化I中使用催化剂,反应的活化能Ea、△H2都减小 | |
| B. | 反应C(s)+H2O(g)+H2(g)=CH3OH(g)△H=41.1 kJ•mol-1 | |
| C. | △H2>△H3 | |
| D. | 图为甲醇燃料电池的工作原理,负极的电极反应为:CH3OH-6e-+6OH-═CO2+5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用右图所示装置除去含CN-、CI-废水中的CN-时,控制溶液pH为9-10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
用右图所示装置除去含CN-、CI-废水中的CN-时,控制溶液pH为9-10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )| A. | 用石墨作阳极,铁作阴极 | |
| B. | 阳极的电极反应式为:Cl-+2OH--2e-═ClO-+H2O | |
| C. | 阴极的电极反应式为:2H++2e-=H2↑ | |
| D. | 除去CN-的反应:2CN-+5ClO-+2H+═N2↑+2CO2↑+5Cl-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 副族元素中没有非金属 | |
| B. | 除短周期外,其他周期均有18种元素 | |
| C. | ⅠA族的所有元素都为金属元素 | |
| D. | 同周期ⅡA族与ⅢA族元素原子序数相差只有1、11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酸性KMnO4溶液可以检验绿矾(FeSO4•7H2O)是否变质 | |
| B. | 非极性键只存在于双原子的单质分子(如Cl2)中 | |
| C. | 在共价化合物分子内,可能存在离子键 | |
| D. | 在氮原子中,质子数为7而中子数不一定为7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com