
【题目】在一定温度下向不同电解质溶液中加入新物质时溶液的导电性能发生变化,如下图所示是其电流(I)随新物质加入量(m)的变化曲线。

以下4个导电性实验,其中与图Ⅰ、图Ⅱ、图Ⅲ对应一致的选项是
①Ba(OH)2溶液中滴入H2SO4溶液至过量
②醋酸溶液中滴入NH3·H2O至过量
③澄清石灰水中通入CO2至过量
④NH4Cl溶液中逐渐加入适量NaOH固体

A. A B. B C. C D. D
【答案】D
【解析】①Ba(OH)2+H2SO4=BaSO4↓+2H2O,滴入H2SO4时,导电性减弱,完全反应后,H2SO4过量,导电性又增强,与B一致;
②CH3COOH+NH3?H2O=CH3COONH4+H2O,导电性增强,但过量后,将溶液稀释,导电性减弱,与A一致;
③Ca(OH)2+CO2=CaCO3↓+H2O,导电性减弱,CO2过量后,CaCO3+CO2+H2O?Ca(HCO3)2,Ca(HCO3)2电离使导电性又增强,与B一致;
④NH4Cl+NaOH=NaCl+NH3?H2O,原为强电解质NH4Cl,反应后仍为强电解质NaCl,NH3?H2O影响不大,与C一致,故答案为:②;①③;④。选D。


科目:高中化学 来源: 题型:
【题目】常温下,0.4mol·L-1—元酸HA与0.2mol·L-1NaOH溶液等体积混合后,所得溶液pH>7,溶液部分微粒组分及浓度如下图所示。下列说法正确的是

A. HA是弱酸
B. 图中未表示出的微粒的浓度小于0.lmol/L
C. 该混合溶液中:c(HA)+c (X)=c(Na+)
D. 图中M表示HA,Y表示OH-,Z表示H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是
A. K值不变,平衡可能移动 B. K值变化,平衡一定移动
C. 平衡移动,K值可能不变 D. 平衡移动,K值一定变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【山西省实验中学2017届下学期模拟热身】[化学―选修3:物质结构与性质]
研究物质的微观结构,有助于人们理解物质变化的本质。请根据已学习的物质结构知识,回答下列问题:
(1)基态Mn原子的价电子排布式为___,气态Mn2+再失去l个电子比Fe2+再失去1个电子更难,其原因是________。
(2)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。实验时形成的深蓝色溶液中的阳离子内存在的全部化学键类型有_____。写出难溶物溶于氨水时的离子方程式__________。实验过程中加入C2H5OH 后可观察到析出深蓝色Cu(NH3)4SO4·5H2O晶体。实验中所加C2H5OH 的作用是______。
(3)HClO2、HClO3为氯元素的含氧酸,试推测ClO2-的空间结构:________;HClO3分子中,Cl原子的杂化方式为______;两种酸酸性较强的是_______.
(4)多磷酸盐的酸根阴离子是由两个或两个以上磷氧四面体通过共用角顶氧原子而连接起来的,部分结构如图所示,多磷酸根离子的通式为______。(磷原子数目用n表示)
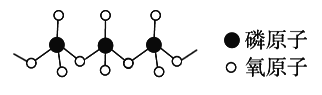
(5)金属Pt采用“…ABCABC…”型堆积方式,抽出一个晶胞,其正确的是________。
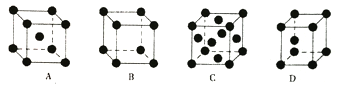
已知金属Pt的密度为21.4 g/cm3,则Pt原子半径的计算式为______pm (只列式,不必计算结果,Pt的相对原子质量为M,阿伏加德罗常数为6.02×1023mol-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. Cl 2 通入水中:Cl 2 +H 2 O == 2H+ +Cl― +ClO―
B. 用氯化铁溶液腐蚀线路板上的铜:Fe 3+ +Cu == Fe 2+ +Cu 2+
C. Al 与 NaOH 溶液反应:2Al+2OH―== 2AlO 2― +H2 ↑
D. 稀硫酸与氢氧化钡溶液混合:2H++SO42―+Ba2+ +2OH― == BaSO4 ↓+2H 2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,Ksp[Mg(OH)2] =5.61×l0-12,Ksp[Al(OH)3] =1.3×l0-33,Al(OH)3![]() AlO2-+H++H2O Ka=6.31×l0-13。某溶液中可能含有 H+、Na+、Mg2+、Al3+、Cl-、HCO3-等离子。向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示。下列有关说法正确的是
AlO2-+H++H2O Ka=6.31×l0-13。某溶液中可能含有 H+、Na+、Mg2+、Al3+、Cl-、HCO3-等离子。向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示。下列有关说法正确的是

A. b 点沉淀—Al(OH)3;d 点沉淀—A1(OH)3和Mg(OH)2;e点溶质—NaA1O2
B. 依据题意,用NaOH不能完全分离Mg2+和Al3+离子
C. cd 段发生的反应为:Mg2+ +2OH- =Mg(OH)2↓
D. bc 段发生的反应为:Al(OH)3+OH-=A1O2-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某透明溶液中含有以下离子中的几种H+、Na+、Fe3+、Cu2+、NH4+、Mg2+、Cl-、NO3-、SO42-、CH3COO-、I-、OH-,且只含有四种阳离子,为确定离子种类设计实验如下(已知氧化性:HNO3>Fe3+>I2) :
①取溶液少许滴加1~2滴紫色石蕊试液后溶液呈红色;
②取100mL溶液,滴加1.0mol/L的NaOH溶液至520mL时恰好完全反应,加热后共收集到0.448L(标准状况下)气体(假设气体全部逸出),同时产生沉淀。将沉淀过滤,洗涤,灼烧后得到一种黑色和白色的固体混合物,称得质量为14.0g。下图为滴加NaOH溶液过程图像(纵坐标为生成沉淀的质量,横坐标为滴加NaOH溶液体积)。继续向滤液中滴加足量的BaCl2溶液,又产生白色沉淀46.6g;

③另取100mL原溶液通入标准状况下1.12LCl2,恰好完全反应,加入四氯化碳后,振荡静置后分层,下层呈现紫色(已知:Cl2+2I-=2Cl-+I2);
④在③中滴加硝酸酸化的硝酸银溶液后生成不溶于稀硝酸的白色沉淀。
结合以上实验现象和数据可知:
(1)溶液中一定不能大量存在____________。
(2)填写表中空格(可以不填满): __________。
离子种类 | ||||||||
离子浓度(mol/L) |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的学科,结合下列实验装置图回答相关问题。

(1)写出下列仪器的名称:a.________;b:_________。
(2)实验室欲利用如图所示的装置来分离乙酸(沸点为118℃)和乙酸乙酯(沸点为77.1℃)的混合物。
①还缺少的仪器是______,将仪器补充完整后进行的实验操作的名称是_____。
②实验时,仪器b中冷却水的进口是______.(填“f”或“g”)。
③实验时,常向仪器a中加入碎瓷片,这样做的目的是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com