
| A. | 20mol•(L•min)-1 | B. | 0.1mol•(L•s)-1 | C. | 0.2mol•(L•s)-1 | D. | 0.4mol•(L•min)-1 |
科目:高中化学 来源: 题型:选择题
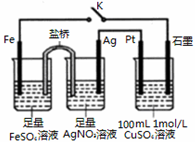
| A. | 盐桥中的电解质可以用KC1 | |
| B. | 闭合K,石墨电极上只生成铜 | |
| C. | 当有0.1mol Fe溶解时,流经电解液的电子个数为1.204×1023 | |
| D. | 导线中流过0.3mol电子时,加入11.1gCu2(OH)2CO3,CuSO4溶液可恢复原组成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol.L-1硫酸钠溶液中含有溶质离子总数为1.5NA | |
| B. | 标准状况下,22.4L甲醇完全燃烧产生NA个CO2分子 | |
| C. | 常温常压下,46g NO2、N2O4混合物中,分子数为NA | |
| D. | 常温常压下,N2和O2混合气体22.4L所含的分子数少于6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粗盐提纯蒸发时,待水分完全蒸干后停止加热 | |
| B. | 过滤时,漏斗下口尖端紧贴烧杯内壁 | |
| C. | 蒸馏时,冷却水应从冷凝管上口进下口出 | |
| D. | 分液操作时,上层液体应从分液漏斗下口放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向0.1molFeI2溶液中滴加少量氯水,反应中有0.3mol电子转移 | |
| B. | 向溴水中加入足量氯化亚铁能使溶液变成无色 | |
| C. | 向NaClO溶液中通入少量CO2的离子方程式:ClO-+CO2+H2O═HClO+HCO3- | |
| D. | 能使pH试纸显深红色的溶液,Fe3+、Cl-、Ba2+、Br-能大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Fe2+、Cl-、SO42- | B. | K+、CO32-、Cl-、SO42- | ||
| C. | Ca2+、Mg2+、NO3-、HCO3- | D. | Na+、Cl-、CO32-、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用加热的方法分离沙子和氯化铵晶体 | |
| B. | 用洁净的铂丝蘸取氯化钠溶液在无色火焰上灼烧,焰色呈黄色 | |
| C. | 胆矾受热变成白色粉末 | |
| D. | 熔融的氯化钠导电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com