
工业制硫酸中的一步重要反应是SO2在400~600℃下的催化氧化:2SO2+O2⇌2SO3,这是一个正反应放热的可逆反应.若反应在密闭容器中进行,下述有关说法中错误的是()
A. 达到平衡时,SO2的浓度与SO3的浓度相等
B. 使用催化剂是为了加快反应速率,提高生产效率
C. 为了提高SO2的转化率,应适当提高O2的浓度
D. 在上述条件下,SO2不可能100%转化为SO3
考点: 化学平衡的影响因素.
分析: A、达到平衡时,各组分浓度不变而不是相等;
B、用催化剂是为了加快反应速率,但平衡不移动,只是缩短时间;
C、因增大反应物O2的浓度,平衡向正反应方向移动,提高了SO2的转化率;
D、因该反应是可逆反应,存在反应限度.
解答: 解:解:A、达到平衡时,SO2的浓度与SO3的浓度可能相等,也可能不相等,要依据反应物的初始浓度及转化率,故A错误;
B、使用催化剂加快了反应速率,缩短反应时间,提高反应效率,平衡不移动,故B正确;
C、因增大反应物O2的浓度,平衡向正反应方向移动,提高了SO2的转化率,故C正确;
D、因该反应是可逆反应,存在反应限度,反应物不可能100%的转化,故D正确;
故选:A.
点评: 本题考查了影响化学平衡移动的因素,难度不大,注意催化剂只影响化学反应速率不影响化学平衡移动.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
某有机物(X)的分子结构模型如图CB32所示(分子中只有C、H、O三种原子)。请回答下列问题:
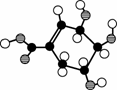
图CB32
(1)观察题图的分子结构模型,写出X分子中包含的官能团的名称:
________、________和________。
(2)下列对有机物X的性质的说法正确的是________。
①能使酸性高锰酸钾溶液褪色
②能使溴水褪色
③1 mol X与足量的金属钠反应能放出标准状况下的氢气22.4 L。
(3)写出X在一定条件下跟氢气反应的化学方程式:________________________________
________________________________________________________________________。
(4)1 mol有机物X完全燃烧需消耗氧气______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物品或设备:①水泥路;②门窗玻璃;③水晶镜片;④石英钟表;⑤玛瑙手镯;⑥硅太阳能电池;⑦光导纤维;⑧计算机芯片。所用材料含有SiO2的是 ( )。
A.①②③④⑤⑦ B.①②⑦⑧
C.⑥⑧ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
近年来发现铊(Tl)是高温超导材料的成分之一,已知铊与铝是同族元素,关于铊的下列性质判断中,可能错误的是()
A. 是银白色、质软的金属 B. 能形成+3价的化合物
C. Tl(OH)3是两性氢氧化物 D. 能与硝酸反应生成硝酸盐
查看答案和解析>>
科目:高中化学 来源: 题型:
甲烷分子是以碳原子为中心的正四面体结构,而不是正方形的平面结构,理由是()
A. CH3Cl不存在同分异构体 B. CH2Cl2不存在同分异构体
C. CHCl3不存在同分异构体 D. CCl4不存在同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求完成下列各题:
(1)用电子式表示Mg Cl2的形成过程.H2O的电子式为.
(2)质量相同的H2O和D2O所含质子数之比为.
(3)利用如图装置采用适当试剂可完成某探究实验,并得出相应实验结论.请根据相关信息回答:
①为了证明元素的非金属性强弱是S>C>Si.你认为各物质应该是:甲为硫酸;乙为;丙为.(已知乙中有气泡产生,丙中有白色沉淀)
②如果甲为水,乙为Na2O2粉末,丙为H2S的饱和水溶液.实验中观察到丙中生成淡黄色沉淀.说明元素O、S非金属性强弱为.
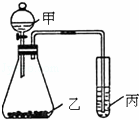
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用溴和苯在FeBr3催化下制取溴苯,得到粗溴苯后,要用如下操作提纯:(1)蒸馏;(2)水洗;(3)用干燥剂干燥;(4)用10%的NaOH溶液洗涤.正确的操作顺序是()
A. (1)(2)(3)(4) B. (4)(2)(3)(1) C. (4)(1)(2)(3) D. (2)(4)(2)(3)(1)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com