
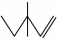
 命名为:3,3-二甲基-1-戊烯;写出该物质与HBr反应的化学方程式:CH3CH2C(CH3)2CH=CH2+HBr→CH3CH2C(CH3)2CHBrCH3
命名为:3,3-二甲基-1-戊烯;写出该物质与HBr反应的化学方程式:CH3CH2C(CH3)2CH=CH2+HBr→CH3CH2C(CH3)2CHBrCH3
分析 (1)烃命名遵循长、多、近、小、简原则,烯烃的命名选取含有碳碳双键的最长碳链,选取距离碳碳双键最近的一端命名为1号碳,碳碳双键与溴化氢发生加成反应;
(2)2-丁烯含有C=C键,在一定条件下能发生加聚反应生成聚2-丁烯;
(3)乙醇在浓硫酸、加热到170度条件下,脱水生成乙烯;
(4)醇羟基在首位的醇,催化氧化得到醛,在中间催化氧化得到酮.
解答 解:(1) 该有机物为烯烃,最长碳链含有5个C,主链为戊烯,编号从距离碳碳双键最近的一端开始,碳碳双键在1、2之间,两个甲基在3号C上,该有机物名称为:3,3-二甲基-1-戊烯,与HBr反应的化学方程式为:CH3CH2C(CH3)2CH=CH2+HBr→CH3CH2C(CH3)2CHBrCH3,
该有机物为烯烃,最长碳链含有5个C,主链为戊烯,编号从距离碳碳双键最近的一端开始,碳碳双键在1、2之间,两个甲基在3号C上,该有机物名称为:3,3-二甲基-1-戊烯,与HBr反应的化学方程式为:CH3CH2C(CH3)2CH=CH2+HBr→CH3CH2C(CH3)2CHBrCH3,
故答案为:3,3-二甲基-1-戊烯;CH3CH2C(CH3)2CH=CH2+HBr→CH3CH2C(CH3)2CHBrCH3;
(2)2-丁烯含有C=C键,在一定条件下能发生加聚反应生成聚2-丁烯,反应的化学方程式为 ,
,
故答案为: ;
;
(3)乙醇在浓硫酸的催化作用下170℃发生分子内脱水生成乙烯,反应的化学方程式为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,
故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
(4)2-甲基-1,2-丁二醇在铜或银做催化剂条件下发生催化氧化生成丙醛和水,反应的方程式为:CH3CH2CHOHCH2OH+O2$→_{△}^{铜或银}$CH3CH2COCHO+2H2O,
故答案为:CH3CH2CHOHCH2OH+O2$→_{△}^{铜或银}$CH3CH2COCHO+2H2O.
点评 本题考查有机化合物的命名、化学反应等知识,题目难度中等,注意有机物的官能团和有机物的性质.


科目:高中化学 来源: 题型:解答题
 铁、铜及其化合物在日常生产、生活有着广泛的应用.请回答下列问题:
铁、铜及其化合物在日常生产、生活有着广泛的应用.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有大量AlO${\;}_{2}^{-}$的溶液中:Na+、OH-、Cl-、CO${\;}_{3}^{2-}$ | |
| B. | 滴加紫色石蕊试液变红的溶液中:K+、Ba2+、CH3COO-、F- | |
| C. | 加入Al能放出H2的溶液中:K+、NH4+、NO3-、HCO3- | |
| D. | 1.0mol?L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ①③⑤ | C. | ①③④ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题.
随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨是非电解质,但液态氯化氢是强电解质 | |
| B. | 体积不同但pH相同的醋酸和盐酸,用蒸馏水分别稀释至原体积的m倍和n倍后两溶液的pH值仍相同,m和n的相对大小无法确定 | |
| C. | CuCl2+2H2O═Cu(OH)2+2HCl,加入少量硝酸银固体后可以增大CuCl2水解程度 | |
| D. | I-、K+、Na+、NO3-、Cl-一定可以在甲基橙呈黄色的溶液中大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入甲烷的电极为电池的负极,通入氧气的电极为正极 | |
| B. | 在标准状况下,每消耗5.6 L O2,可向外提供2.4×104 C的电量 | |
| C. | 通入甲烷电极的电极反应为:CH4+10OH--8e-═CO32-+7H2O | |
| D. | 放电一段时间后,溶液的pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com