
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
分析 ①红外光谱图的分析可以初步判断有机物中具有哪些基团;
②结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物;
③分子组成相差一个或若干个CH2原子团的物质,其分子结构不一定相似;
④同分异构体是指有着相同分子式的分子;各原子间的化学键也常常是相同的;但是原子的排列却是不同的.也就是说,它们有着不同的“结构式”.许多同分异构体有着相同或相似的化学性质
解答 解:①红外光谱图可确定有机物的化学键和官能团,可以初步判断有机物中具有哪些基团,故①正确;
②分子组成相差一个或若干个CH2原子团的物质,其分子结构不一定相似,如CH2=CH2与 ,故②错误;
,故②错误;
③同系物结构相似,一定同类;在分子组成上相差一个或若干个CH2原子团,故电子数之差一定为8的整数倍,故③正确;
④同分异构体的种类很多,有官能团异构,性质不相似,但还有其他异构,如位置异构,如1-丁烯和2-丁烯,都是烯烃,性质相似,故④错误;
故选B.
点评 本题考查有机物的结构和性质,为高频考点,侧重考查学生的分析能力,注意把握有机物的结构和官能团的性质,把握有机物的组成和同分异构体的判断,难度不大.


科目:高中化学 来源: 题型:解答题
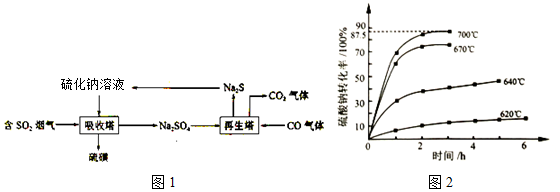
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 起始浓度 | 甲 | 乙 | 丙 |
| c(NO2)/mol•L-1 | 0.10 | 0.20 | 0.20 |
| C(SO2)/mol•L-1 | 0.10 | 0.10 | 0.20 |
| A. | 容器甲中的反应在前2 min的平均速率v(SO2)=0.05 mol•L-1•min-1 | |
| B. | 达到平衡时,容器丙中正反应速率与容器甲相等 | |
| C. | 温度升至90℃,上述反应平衡常数为1.56,则反应的△H>0 | |
| D. | 容器乙中若起始时改充0.10 mol•L-1 NO2和0.20mol•L-1 SO2,达到平衡时c(NO)与原平衡相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴水 | B. | NaHCO3溶液 | C. | 乙醇 | D. | 酸性KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1.12L 氦气所含原子数为0.1NA | |
| B. | 22.4 LHCl溶于水,溶液中H+数为NA | |
| C. | 1.6gNH2-离子所含电子数为NA | |
| D. | 10g D2O所含的中子数为4.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ①③ | C. | ②③ | D. | ① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不能判断溶液中是否存在SO42- | B. | 溶液中一定不存在的离子是CO32 | ||
| C. | 不能判断溶液中是否存在Ag+ | D. | 不能判断是否含有[Al(OH)]4-离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com