
| A. | 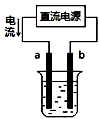 用装置精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 | |
| B. | 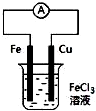 装置的总反应是:Cu+2Fe3+═Cu2++2Fe2+ | |
| C. | 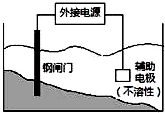 装置中钢闸门应与外接电源的负极相连 | |
| D. | 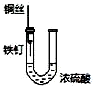 装置中的发生的是铁钉的析氢腐蚀 |
分析 A.电解精炼铜时,粗铜作阳极,纯铜作阴极;
B、铁比铜活泼,所以铁是负极;
C、金属的腐蚀与防护中,被保护的金属应该与电源的负极相连;
D、电解质溶液呈酸性,发生析氢腐蚀.
解答 解:A.根据电流方向知,a是电解池阳极,b是电解池阴极,用装置①精炼铜,粗铜作阳极,纯铜作阴极,电解质溶液是含有铜离子的可溶性盐溶液,所以a极为粗铜,电解质溶液为硫酸铜溶液,故A正确;
B、铁比铜活泼,所以铁是负极,电极总反应式为:Fe+2Fe3+═3Fe2+,故B错误;
C、电解池的负极上电解质溶液中阴离子导电,所以阴极金属被保护,则为了保护金属不被腐蚀,被保护的金属应该与电源的负极相连,故C正确;
D、电解质溶液是浓硫酸,呈酸性,发生析氢腐蚀,故D正确;
故选B.
点评 不同考查原电池和电解池原理、金属的腐蚀的类型等知识点,注意精炼铜时粗铜作阳极,纯铜为阴极,为易错点.


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 通入少量 HCl 气体 | B. | 加入少量 NaOH 固体 | ||
| C. | 加入少量 H2O | D. | 适当升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
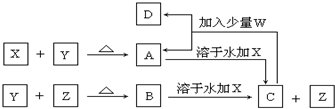
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠溶液 | B. | 硫酸氢钠溶液 | C. | 硫酸钾溶液 | D. | 硝酸钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将金属钠在研体中研成粉末,使钠与水反应的实验更安全 | |
| B. | 用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸 | |
| C. | 分液时,分液漏斗内的上层液体应由上口倒出 | |
| D. | 用滴定管取液时,开始和最后读数时均俯视,则量取的体积准确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液面在“0”刻度时,25mL碱式滴定管和50mL碱式滴定管所盛溶液的体积 | |
| B. | 在过氧化钠固体中,阴离子与阳离子的个数 | |
| C. | 将质量分数为a%的H2SO4溶液蒸发水后变为2a%,蒸发前后H2SO4溶液的物质的量浓度 | |
| D. | 在碳与浓硫酸(加热)的反应中,被还原的H2SO4与参加反应的H2SO4的物质的量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com