
| 离子组 | 加入试剂 | 离子方程式 | |
| A | Al3+、SO42- | 适量Ba(OH)2溶液 | Al3++3OH-═Al(OH)3↓ |
| B | Fe2+、I- | 足量新制氯水 | Cl2+2I-═2Cl-+I2 |
| C | Fe3+、NO3- | NaHSO3溶液 | 3SO32-+2NO3-+2H+═3SO42-+2NO↑+H2O |
| D | Ca2+、HCO3- | 氨水 | Ca2++2HCO3-+2NH3•H2O═CaCO3↓+CO32-+2NH4++2H2O |
| A. | A | B. | B | C. | C | D. | D |
分析 A.漏掉了钡离子与硫酸根离子的反应;
B.氯水足量,亚铁离子和碘离子都完全被氧化;
C.亚硫酸氢根离子不能拆开;
D.碳酸氢根离子与氨水反应生成碳酸铵,碳酸铵与钙离子结合生成碳酸钙沉淀.
解答 解:A.加入适量Ba(OH)2溶液后,Al3+、SO42-都参与反应,正确的离子方程式为:Al3++3OH-═Al(OH)3↓、Ba2++SO42-═BaSO4↓,故A错误;
B.加入足量新制氯水,Fe2+、I-都被氧化,正确的离子方程式为:Cl2+2I-═2Cl-+I2、Cl2+2Fe2+═2Cl-+2Fe3+,故B错误;
C.亚硫酸为弱酸,亚硫酸氢根离子不能拆开,正确的离子方程式为:3HSO3-+2NO3-═3SO42-+2NO↑+H+,故C错误;
D.Ca2+、HCO3-与氨水反应生成碳酸钙沉淀,反应的离子方程式为:Ca2++2HCO3-+2NH3•H2O═CaCO3↓+CO32-+2NH4++2H2O,故D正确;
故选D.
点评 本题考查离子方程式的书写,题目难度中等,明确发生反应的实质为解答关键,注意掌握离子方程式的书写原则,试题有利于提高学生的分析能力及规范答题能力.


科目:高中化学 来源: 题型:选择题
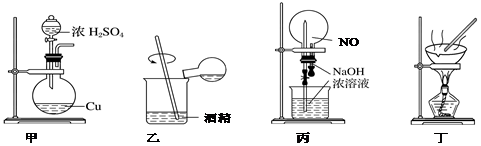
| A. | 用图甲做铜与浓硫酸反应制取SO2 | |
| B. | 用图乙配制浓硫酸与酒精的混合液 | |
| C. | 用图丙做NO与NaOH溶液的“喷泉”实验 | |
| D. | 用装置丁做蒸发CuCl2溶液获得CuCl2•2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷与氯气光照反应可以制得较纯净的1,2-二氯乙烷 | |
| B. | 苯中的化学键都是非极性键 | |
| C. | 煤的干馏属于物理变化 | |
| D. | 涤纶、酚醛树脂和蛋白质都属于高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) 浓度(mol/L) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(CO) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用NaHCO3和Al2(SO4)3溶液可以制作泡沫灭火剂 | |
| B. | 为了防止蛋白质盐析,疫苗等生物制剂应冷冻保藏 | |
| C. | 溴化银见光易分解,可用作胶片感光剂 | |
| D. | 硅胶多孔,常用作食品干燥剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径逐渐增大 | |
| B. | 单质氧化性逐渐增强 | |
| C. | 气态氢化物的稳定性逐渐增强 | |
| D. | 都有最高价氧化物的水化物,化学式为HXO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
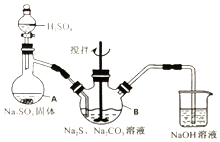 硫代硫酸钠(Na2S2O3•5H2O)俗名“大苏打”,又称为“海波”.它易溶于水,难溶于乙醇,加热、遇酸均易分解.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:
硫代硫酸钠(Na2S2O3•5H2O)俗名“大苏打”,又称为“海波”.它易溶于水,难溶于乙醇,加热、遇酸均易分解.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:| 编号 | 1 | 2 | 3 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.98 | 22.50 | 20.02 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com