
”¾ĢāÄæ”æøł¾ŻĢāŅā½ā“š
£Ø1£©Ä³ŹµŃ銔×éĶ¬Ń§½ųŠŠČēĻĀŹµŃ飬ŅŌ¼ģŃé»Æѧ·“Ó¦ÖŠµÄÄÜĮæ±ä»Æ£¬ŹµŃéÖŠ·¢ĻÖ£¬·“Ó¦ŗó¢ŁÖŠµÄĪĀ¶ČÉżøߣ»¢ŚÖŠµÄĪĀ¶Č½µµĶ£®ÓÉ“ĖÅŠ¶ĻĀĮĢõÓėŃĪĖįµÄ·“Ó¦ŹĒ___________ČČ·“Ó¦£¬Ba£ØOH£©28H2OÓėNH4ClµÄ·“Ó¦ŹĒ________________________ČČ·“Ó¦£®·“Ó¦¹ż³Ģ___________________________£ØĢī”°¢Ł”±»ņ”°¢Ś”±£©µÄÄÜĮæ±ä»ÆæÉÓĆĶ¼2±ķŹ¾£®

£Ø2£©ĪŖĮĖŃéÖ¤Fe3+ÓėCu2+Ńõ»ÆŠŌĒæČõ£¬ĻĀĮŠ×°ÖĆÄÜ“ļµ½ŹµŃéÄæµÄŹĒ_________£ØĢīŠņŗÅ£©£®

£Ø3£©½«CH4Éč¼Ę³ÉČ¼ĮĻµē³Ų£¬ĘäĄūÓĆĀŹøüøߣ¬×°ÖĆČēĶ¼4ĖłŹ¾£Øa”¢bĪŖ¶ąæ×Ģ¼°ō£©“¦µē¼«ČėæŚĶؼ×Ķé£ØĢīA»ņB£©£¬Ęäµē¼«·“Ó¦Ź½ĪŖ_____________________ £®

£Ø4£©ČēĶ¼5ŹĒij»ÆѧŠĖȤŠ”×éĢ½¾æ²»Ķ¬Ģõ¼žĻĀ»ÆѧÄÜ×Ŗ±äĪŖµēÄܵÄ×°ÖĆ£®Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
¢Łµ±µē¼«aĪŖAl”¢µē¼«bĪŖCu”¢µē½āÖŹČÜŅŗĪŖĻ”ĮņĖįŹ±£¬Š“³öøĆŌµē³ŲÕż¼«µÄµē¼«·“Ó¦Ź½ĪŖ___________________________ £®
¢Śµ±µē¼«aĪŖAl”¢µē¼«bĪŖMg”¢µē½āÖŹČÜŅŗĪŖĒāŃõ»ÆÄĘČÜŅŗŹ±£¬øĆŌµē³ŲµÄÕż¼«ĪŖ_______£»øĆŌµē³ŲµÄøŗ¼«·“Ó¦Ź½ĪŖ_____________________________£®
”¾“š°ø”æ·Å Īü ¢Ł ¢Ś A£¬CH4©8e©+10OH©=CO32©+7H2O 2H++2e©ØTH2”ü Mg Al+4OH©©3e©=AlO2©+2H2O
”¾½āĪö”æ
(1)»Æѧ·“Ó¦ÖŠ,ĪĀ¶ČÉżøß,Ōņ·“Ó¦·ÅČČ£¬ĪĀ¶Č½µµĶŌņ·“Ó¦ĪüČČ£»Ķ¼2ÖŠ·“Ó¦Īļ×ÜÄÜĮæ“óÓŚÉś³ÉĪļ×ÜÄÜĮæ,øĆ·“Ó¦ĪŖ·ÅČČ·“Ó¦,¾Ż“Ė½ųŠŠ½ā“š£»
(2)ŃéÖ¤Fe3+ÓėCu2+Ńõ»ÆŠŌĒæČõ,ŌŚŌµē³ŲÖŠ,Ķ×÷øŗ¼«”¢ĘäĖüµ¼µēµÄ½šŹō»ņ·Ē½šŹō×÷Õż¼«,µē½āÖŹČÜŅŗĪŖæÉČÜŠŌµÄĢśŃĪ£»
(3)øł¾Żµē×ÓĮ÷ĻņÖŖ,AĪŖøŗ¼«”¢BĪŖÕż¼«,Č¼ĮĻµē³ŲÖŠĶØČėČ¼ĮĻµÄµē¼«ĪŖøŗ¼«”¢ĶØČėŃõ»Æ¼ĮµÄµē¼«ĪŖÕż¼«,¼×Ķ鏧µē×ÓŗĶĒāŃõøłĄė×Ó·“Ӧɜ³ÉĢ¼ĖįøłĄė×ÓŗĶĖ®£»
(4)¢ŁAl”¢Cu”¢Ļ”ĮņĖį¹¹³ÉµÄŌµē³Ų,½šŹōAl×÷øŗ¼«,½šŹōCuĪŖÕż¼«,Õż¼«ÉĻĒāĄė×ӵƵ½µē×Ó,øŗ¼«ÉĻAlŹ§Č„µē×Ó£»
¢ŚAl”¢Mg”¢NaOHČÜŅŗ¹¹³ÉµÄŌµē³ŲÖŠ£¬AlĪŖøŗ¼«£¬MgĪŖÕż¼«,øŗ¼«ÉĻAlŹ§Č„µē×Ó,Õż¼«ÉĻĖ®ÖŠµÄĒāĄė×ӵƵ½µē×Ó£¬ŅŌ“ĖĄ“½ā“š”£
(1)ĶعżŹµŃé²ā³ö,·“Ó¦Ē°ŗó¢ŁÉÕ±ÖŠµÄĪĀ¶ČÉżøß,ŌņAløśŃĪĖįµÄ·“Ó¦ŹĒ·ÅČČ·“Ó¦,¢ŚÉÕ±ÖŠµÄĪĀ¶Č½µµĶ,ŌņBa£ØOH£©28H2OÓėNH4ClµÄ·“Ó¦ŹĒĪüČČ·“Ó¦£»øł¾ŻĶ¼2Źż¾ŻæÉŅŌÖŖµĄ,øĆ·“Ó¦ÖŠ,·“Ó¦Īļ×ÜÄÜĮæ“óÓŚÉś³ÉĪļ×ÜÄÜĮæ,ŌņøĆ·“Ó¦ĪŖ·ÅČČ·“Ó¦,æɱķŹ¾·“Ó¦¢ŁµÄÄÜĮæ±ä»Æ£»Ņņ“Ė£¬±¾ĢāÕżČ·“š°øŹĒ£ŗ·Å£¬ Īü£¬ ¢Ł ”£
(2)ŃéÖ¤Fe3+ÓėCu2+Ńõ»ÆŠŌĒæČõ,ŌŚŌµē³ŲÖŠ,Ķ×÷øŗ¼«”¢ĘäĖüµ¼µēµÄ½šŹō»ņ·Ē½šŹō×÷Õż¼«,µē½āÖŹČÜŅŗĪŖæÉČÜŠŌµÄĢśŃĪ£¬
¢ŁÖŠĢś×÷øŗ¼«”¢Cu×÷Õż¼«,µē³Ų·“Ó¦Ź½ĪŖFe+2Fe3+=3Fe2+,²»ÄÜŃéÖ¤Fe3+ÓėCu2+Ńõ»ÆŠŌĒæČõ,¹Ź“ķĪó£»
¢ŚÖŠĶ×÷øŗ¼«”¢Ņų×÷Õż¼«,µē³Ų·“Ó¦Ź½ĪŖCu+2Fe3+=2Fe2++ Cu2+£¬ÄÜŃéÖ¤Fe3+ÓėCu2+Ńõ»ÆŠŌĒæČõ,¹ŹÕżČ·£»
¢ŪÖŠĢś·¢Éś¶Ū»ÆĻÖĻó,Cu×÷øŗ¼«”¢Ģś×÷Õż¼«,µē³Ų·“Ó¦Ź½ĪŖ: Cu+4H++2NO3-=Cu2++2NO2”ü+2H2O£¬²»ÄÜŃéÖ¤Fe3+ÓėCu2+Ńõ»ÆŠŌĒæČõ£¬¹Ź“ķĪó£»
¢ÜÖŠĢś×÷øŗ¼«”¢Ķ×÷Õż¼«,µē³Ų·“Ó¦Ź½ĪŖ: Fe+ Cu2+= Cu2++ Fe2+£¬²»ÄÜŃéÖ¤Fe3+ÓėCu2+Ńõ»ÆŠŌĒæČõ£¬¹Ź“ķĪó£»
Ņņ“Ė£¬±¾ĢāÕżČ·“š°øŹĒ:¢Ś”£
(3)øł¾Żµē×ÓĮ÷ĻņÖŖ,AĪŖøŗ¼«”¢BĪŖÕż¼«,Č¼ĮĻµē³ŲÖŠĶØČėČ¼ĮĻµÄµē¼«ĪŖøŗ¼«”¢ĶØČėŃõ»Æ¼ĮµÄµē¼«ĪŖÕż¼«,ĖłŅŌA“¦ĶØČė¼×Ķé,¼×Ķ鏧µē×ÓŗĶĒāŃõøłĄė×Ó·“Ӧɜ³ÉĢ¼ĖįøłĄė×ÓŗĶĖ®,µē¼«·“Ó¦Ź½ĪŖCH4©8e©+10OH©=CO32©+7H2O £»
Ņņ“Ė£¬±¾ĢāÕżČ·“š°øŹĒ:A£»CH4©8e©+10OH©=CO32©+7H2O”£
(4)¢ŁAl”¢Cu”¢Ļ”ĮņĖį¹¹³ÉµÄŌµē³Ų,½šŹōAl×÷øŗ¼«,½šŹōCuĪŖÕż¼«,Õż¼«ÉĻĒāĄė×ӵƵ½µē×Ó,øŗ¼«ÉĻAlŹ§Č„µē×Ó,Õż¼«·“Ó¦ĪŖ2H++2e©ØTH2”ü£»
Ņņ“Ė£¬±¾ĢāÕżČ·“š°øŹĒ£ŗ2H++2e©ØTH2”ü£»
¢ŚAl”¢Mg”¢NaOHČÜŅŗæɹ¹³ÉŌµē³Ų,AlĪŖøŗ¼«,MgĪŖÕż¼«,øŗ¼«ÉĻAlŹ§Č„µē×Ó,Õż¼«ÉĻĖ®ÖŠµÄĒāĄė×ӵƵ½µē×Ó,·¢Éśµē³ŲĄė×Ó·“Ó¦ĪŖAl+4OH©©3e©=AlO2©+2H2O£»
Ņņ“Ė£¬±¾ĢāÕżČ·“š°øŹĒ£ŗMg£»Al+4OH©©3e©=AlO2©+2H2O”£


 ĆĻ½ØĘ½Š”ѧ¹ö¶Æ²āŹŌĻµĮŠ“š°ø
ĆĻ½ØĘ½Š”ѧ¹ö¶Æ²āŹŌĻµĮŠ“š°ø »ĘøŌĢģĢģĮ·æŚĖćĢāæØĻµĮŠ“š°ø
»ĘøŌĢģĢģĮ·æŚĖćĢāæØĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅ»ÖÖĄūÓĆĖ®īÜæó[Ö÷ŅŖ³É·ÖĪŖCo2O3”¢Co(OH)3£¬»¹ŗ¬ÉŁĮæFe2O3”¢Al2O3”¢MnOµČ]ÖĘČ”CoCl2”¤6H2OµÄ¹¤ŅÕĮ÷³ĢČēĻĀ£ŗ
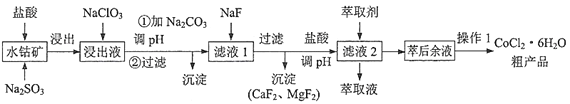
ŅŃÖŖ£ŗ¢Ł½ž³öŅŗŗ¬ÓŠµÄŃōĄė×ÓÖ÷ŅŖÓŠH+”¢Co2+”¢Fe2+”¢Al3+”¢Mn2+”¢Ca2+”¢Mg2+µČ
¢Ś²æ·ÖŃōĄė×ÓæŖŹ¼³ĮµķŗĶĶźČ«³ĮµķµÄpH¼ūĻĀ±ķ

¢ŪCoCl2”¤6H2OČŪµć86”ę£¬Ņ×ČÜÓŚĖ®”¢ŅŅĆŃµČ£»³£ĪĀĻĀĪČ¶Ø£¬¼ÓČČÖĮ110~120”ꏱŹ§Č„½į¾§Ė®±ä³ÉĪŽĖ®ĀČ»ÆīÜ”£
(1)Š“³öCo2O3ÓėNa2SO3ŗĶŃĪĖį·“Ó¦µÄĄė×Ó·½³ĢŹ½______________________”£
(2)¼ÓČėNaClO3µÄÄæµÄŹĒ______________________£»¼ÓČė¹żĮæNaClO3æÉÄÜÉś³ÉÓŠ¶¾ĘųĢ壬øĆĘųĢåŹĒ___________(Ģī»ÆѧŹ½)
(3)ĪŖĮĖ³żČ„Fe3+”¢Al3+£¬Šč¼ÓNa2CO3µ÷pH£¬ŌņpHÓ¦æŲÖʵķ¶Ī§ĪŖ_____________________.
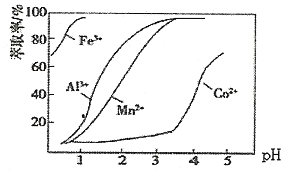
(4)¼ÓŻĶČ”¼ĮµÄÄæµÄŹĒ___________£»½šŹōĄė×ÓŌŚŻĶČ”¼ĮÖŠµÄŻĶČ”ĀŹÓėpHµÄ¹ŲĻµČēĶ¼£¬¾Ż“Ė·ÖĪöpHµÄ×ī¼Ń·¶Ķ¼ĪŖ___________(Ģī×ÖÄøŠņŗÅ)”£
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(5)CoCl2”¤6H2O³£ÓĆ¼õŃ¹ŗęøÉ·ØŗęøÉ£¬ŌŅņŹĒ___________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŻĘĘ·“¼æÉ×÷ĪŖĻū¶¾¼Į”¢æ¹Ńõ»Æ¼Į”¢Ņ½Ņ©ŗĶČܼĮ”£ŗĻ³É¦ĮŻĘĘ·“¼GµÄĀ·ĻßÖ®Ņ»ČēĻĀ:

ŅŃÖŖ£ŗ
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©AĖłŗ¬¹ŁÄÜĶŵÄĆū³ĘŹĒ_____”£
£Ø2£©BµÄ·Ö×ÓŹ½ĪŖ_____£»Š“³öĶ¬Ź±Āś×ćĻĀĮŠĢõ¼žµÄBµÄĮ“דĶ¬·ÖŅģ¹¹ĢåµÄ½į¹¹¼ņŹ½£ŗ_______________”£
¢Ł ŗĖ“Ź²ÕńĒāĘ×ÓŠ2øöĪüŹÕ·å ¢Ś ÄÜ·¢ÉśŅų¾µ·“Ó¦
£Ø3£© B ”ś C”¢E ”ś FµÄ·“Ó¦ĄąŠĶ·Ö±šĪŖ_____”¢_____”£
£Ø4£©C ”ś DµÄ»Æѧ·½³ĢŹ½ĪŖ_____”£
£Ø5£© Ķعż³£ĪĀĻĀµÄ·“Ó¦£¬Ēų±šE”¢FŗĶGµÄŹŌ¼ĮŹĒ_____ŗĶ_____”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÉč°¢·ü¼ÓµĀĀŽ³£ŹżµÄŹżÖµĪŖNA£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A.1molSÓė×ćĮæFe·“Ó¦£¬×ŖŅʵĵē×ÓŹżĪŖ3NAøö
B.1.5 mol NO2Óė×ćĮæH2O·“Ó¦£¬×ŖŅʵĵē×ÓŹżĪŖ2NAøö
C.³£ĪĀ³£Ń¹ĻĀ£¬46 gµÄNO2ŗĶN2O4»ģŗĻĘųĢåŗ¬ÓŠµÄŌ×ÓŹżĪŖ3NAøö
D.100 ml 0.10mol /LµÄ°±Ė®ÖŠ£¬ŗ¬NH3”¤H2O ·Ö×Ó0.01NAøö
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ”°84”±Ļū¶¾Ņŗ£ØÓŠŠ§³É·ÖĪŖ![]() £©æÉÓĆÓŚĻū¶¾ŗĶĘÆ°×£¬ĻĀĮŠŹµŃéĻÖĻóµÄ·ÖĪö²»ÕżČ·µÄŹĒ
£©æÉÓĆÓŚĻū¶¾ŗĶĘÆ°×£¬ĻĀĮŠŹµŃéĻÖĻóµÄ·ÖĪö²»ÕżČ·µÄŹĒ
ŹµŃé²Ł×÷ | ¢Ł
| ¢Ś | ¢Ū
|
ŹµŃéĻÖĻó | »ģŗĻŗóČÜŅŗµÄ | »ģŗĻŗóČÜŅŗ | »ģŗĻŗóČÜŅŗ |
A. ¶Ō±ČŹµŃé¢ŁŗĶ¢Ś£¬¢ŚÖŠĄ¶É«ŃøĖŁĶŹČ„µÄŌŅņŹĒ·¢ÉśĮĖ·“Ó¦![]()
B. ŹµŃé¢ŪÖŠ²śÉśµÄĘųĢåŹĒ![]() £¬ÓÉ
£¬ÓÉ![]() ·Ö½āµĆµ½£ŗ
·Ö½āµĆµ½£ŗ![]()
C. ¶Ō±ČŹµŃé¢ŚŗĶ¢Ū£¬ČÜŅŗµÄ![]() æÉÄÜ»įÓ°Ļģ
æÉÄÜ»įÓ°Ļģ![]() µÄŃõ»ÆŠŌ»ņ
µÄŃõ»ÆŠŌ»ņ![]() µÄ»¹ŌŠŌ
µÄ»¹ŌŠŌ
D. ¼ÓĖįæÉŅŌĢįøß”°84”±Ļū¶¾ŅŗµÄĘư׊§¹ū£¬µ«ŠčŅŖµ÷æŲµ½ŗĻŹŹµÄ![]() ²ÅÄÜ°²Č«Ź¹ÓĆ
²ÅÄÜ°²Č«Ź¹ÓĆ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ(1)±ź×¼×“æöĻĀ£¬1.204”Į1023øöŃõĘų·Ö×ÓµÄĢå»żŹĒ________L£»
(2)±ź×¼×“æöĻĀ£¬Ä³ĘųĢåµÄĆܶČĪŖ1.25 g”¤L£1£¬ŌņĘäĦ¶ūÖŹĮæĪŖ________£»
(3)½«4.6 gÄĘĶ¶Čė×ćĮæµÄĖ®ÖŠ£¬Éś³ÉNaOHµÄÖŹĮæĪŖ______g£¬Éś³ÉH2µÄĢå»żŌŚ±ź×¼×“æöĻĀĪŖ____________”£
(4)400 mLijÅØ¶ČµÄNaOHČÜŅŗĒ”ŗĆÓė11.2 L Cl2(±ź×¼×“æö)ĶźČ«·“Ó¦£¬Éś³ÉNaClOµÄĪļÖŹµÄĮæĪŖ________£¬ŌNaOHČÜŅŗĪļÖŹµÄĮæÅضČĪŖ_________________”£
(5)ŌŚ±ź×¼×“æöĻĀ£¬COŗĶCO2µÄ»ģŗĻĘųĢå¹²17.92 L£¬ÖŹĮæĪŖ28.8 g”£ŌņĮ½ÖÖĘųĢåµÄĪļÖŹµÄĮæÖ®ŗĶĪŖ____________mol£¬ĘäÖŠCO2ĪŖ________mol”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ£Ø1£©ŌŚøßĪĀĻĀŅ»Ńõ»ÆĢ¼æɽ«¶žŃõ»ÆĮņ»¹ŌĪŖµ„ÖŹĮņ”£
ŅŃÖŖ£ŗ¢ŁC(s)£«O2(g)===CO2(g)£»¦¤H1£½£393.5 kJ”¤mol£1
¢ŚCO2(g)£«C(s)===2CO(g)£»¦¤H2£½£«172.5 kJ”¤mol£1
¢ŪS(s)£«O2(g)===SO2(g)£»¦¤H3£½£296.0 kJ”¤mol£1
ĒėŠ“³öCOÓėSO2·“Ó¦µÄČČ»Æѧ·½³ĢŹ½__________________________
£Ø2£©ŌŚ2 L¹Ģ¶ØĢå»żµÄĆܱÕČŻĘ÷ÄŚ£¬800”ꏱ·“Ó¦2NO(g)£«O2(g) ![]() 2NO2(g)ĢåĻµÖŠ£¬n(NO)Ėꏱ¼äµÄ±ä»ÆČē±ķ£ŗ
2NO2(g)ĢåĻµÖŠ£¬n(NO)Ėꏱ¼äµÄ±ä»ÆČē±ķ£ŗ
Ź±¼ä(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
¢ŁŠ“³öøĆ·“Ó¦µÄĘ½ŗā³£Źż±ķ“ļŹ½£ŗK£½_______________________”£ŅŃÖŖ£ŗK300”ę>K350”ę£¬ŌņøĆ·“Ó¦ŹĒ______·“Ó¦£ØĢī”°·ÅČČ”±»ņ”°ĪüČČ”±£©”£
¢ŚĻĀĶ¼±ķŹ¾NO2µÄ±ä»ÆµÄĒśĻߏĒ__________”£ÓĆO2±ķŹ¾“Ó0”«2 sÄŚøĆ·“Ó¦µÄĘ½¾łĖŁĀŹv£½__________”£

¢ŪÄÜĖµĆ÷øĆ·“Ó¦ŅŃ“ļµ½Ę½ŗāדĢ¬µÄŹĒ________”£
a£®v(NO2)£½2v(O2) b£®ČŻĘ÷ÄŚŃ¹Ēæ±£³Ö²»±ä
c£®vÄę(NO)£½2vÕż(O2) d£®ČŻĘ÷ÄŚĆܶȱ£³Ö²»±ä
¢ÜĪŖŹ¹øĆ·“Ó¦µÄ·“Ó¦ĖŁĀŹŌö“ó£¬ĒŅĘ½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶ÆµÄŹĒ________”£
a£®¼°Ź±·ÖĄė³öNO2ĘųĢå b£®ŹŹµ±ÉżøßĪĀ¶Č
c£®Ōö“óO2µÄÅØ¶Č d£®Ń”Ōńøߊ§“߻ƼĮ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¶ŌÓŚĶ¬ĪĀĶ¬Ń¹ĻĀµČÖŹĮæµÄCOŗĶCO2£¬ĻĀĮŠŠšŹöÕżČ·µÄŹĒ(””””)
A. Ģå»żÖ®±ČĪŖ2”Ć1 B. Ģå»żÖ®±ČĪŖ7”Ć1
C. Ėłŗ¬Ō×ÓŹżÖ®±ČĪŖ22”Ć21 D. ĆܶČÖ®±ČĪŖ11”Ć7
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŌ·Ļ¾ÉĒ¦Ėįµē³ŲÖŠµÄŗ¬Ē¦·ĻĮĻ£ØPb”¢PbO”¢PbO2”¢PbSO4¼°ĢæŗŚµČ£©ŗĶH2SO4ĪŖŌĮĻ£¬Öʱøøß“æPbO£¬ŹµĻÖĒ¦µÄŌŁÉśĄūÓĆ”£Ę乤×÷Į÷³ĢČēĻĀ£ŗ

£Ø1£©Ē¦ŹĒĢ¼µÄĶ¬×åŌŖĖŲ£¬ĒŅ±ČĢ¼¶ą4øöµē×Ó²ć£¬ŌņĒ¦Ī»ÓŚŌŖĖŲÖÜĘŚ±ķµŚ____ÖÜĘŚ___×å
£Ø2£©¹ż³Ģ¢ńÖŠ£¬ŌŚFe2+“ß»ÆĻĀ£¬PbŗĶPbO2·“Ӧɜ³ÉPbSO4µÄĄė×Ó·½³ĢŹ½ŹĒ________________”£
£Ø3£©¹ż³Ģ¢ńÖŠ£¬Fe2+“߻ƹż³ĢæɱķŹ¾ĪŖ£ŗ
i£ŗ2Fe2++ PbO2+4H++SO42£½2Fe3++PbSO4+2H2O ii: ””
¢Ł Š“³öiiµÄ»Æѧ·½³ĢŹ½£ŗ_________________________”£
¢Ś ĒėÉč¼ĘŹµŃé·½°øæÉÖ¤ŹµÉĻŹö“߻ƹż³Ģ”£½«ŹµŃé·½°ø²¹³äĶźÕū”£
a.ĻņĖį»ÆµÄFeSO4ČÜŅŗÖŠ¼ÓČė__________ČÜŅŗ£¬ČÜŅŗĪŽŃÕÉ«±ä»Æ£¬ŌŁ¼ÓČėÉŁĮæPbO2£¬ČÜŅŗ±äĪŖ________É«”£
b.ĻņaµĆµ½µÄČÜŅŗÖŠ¼ÓČė___________________,ČÜŅŗ»Öø“ŌĄ“µÄŃÕÉ«”£
£Ø4£©¹ż³ĢIIÖŠ¹żĀĖ²Ł×÷ĖłŠčŅŖµÄ²£Į§ŅĒĘ÷ÓŠ__________________________”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com