
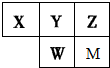
| A、原子半径大小:r(X)>r(Y)>r(W)>r(Z) |
| B、甲物质由M和Z元素组成,溶于水后一定得到甲的水溶液 |
| C、氢化物的稳定性:X>Y;氧化物水化物的酸性:W>Y>M |
| D、Y的气态氢化物(YH3)的空间结构为三角锥形 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 催化剂 |
| △ |
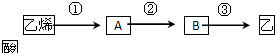
查看答案和解析>>
科目:高中化学 来源: 题型:
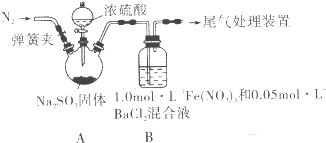
| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| ①配溶液 ②… |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、白磷保存在水中 |
| B、金属钠保存在煤油中 |
| C、浓硝酸保存在棕色试剂瓶中 |
| D、氢氧化钠溶液保存在带磨口玻璃塞的玻璃瓶中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com