
| A. | c(Na+)>c(N3-) | B. | c(N${\;}_{3}^{-}$)>c(OH-) | ||
| C. | c(H+)>c(OH-) | D. | c(Na+)=c(N${\;}_{3}^{-}$)+c(HN3) |
分析 已知叠氮酸(HN3)的Ka=10-4.7.为弱酸,0.1mol•L-1的NaN3溶液中阴离子水解溶液显碱性
解答 解:A.0.1mol•L-1的NaN3溶液中阴离子N3-水解溶液显碱性,c(Na+)>c(N3-),故A正确;
B.N3-+H2O?HN3+OH-,c(N3-)>c(OH-),故B正确;
C.0.1mol•L-1的NaN3溶液中阴离子N3-水解溶液显碱性,N3-+H2O?HN3+OH-,c(H+)<c(OH-),故C错误;
D.溶液中存在物料守恒c(Na+)=c(N3-)+c(HN3),故D正确;
故选C.
点评 本题考查了盐类水解、弱电解质电离平衡、离子浓度大小比较等知识点,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 将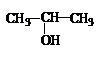 与NaOH的水溶液共热制备CH3-CH═CH2 与NaOH的水溶液共热制备CH3-CH═CH2 | |
| B. | 用甲苯与稀硝酸、稀硫酸的混合酸相混制取TNT | |
| C. | 甲苯在溴化铁催化作用下与液溴反应生成2,4,6-三溴甲苯 | |
| D. | 向CH3CH2Br中滴入AgNO3溶液就可以检验溴元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 偏二甲肼的摩尔质量为60g | |
| B. | 6.02×1023个偏二甲肼分子的质量约为60g | |
| C. | 1mol偏二甲肼的质量为60g/mol | |
| D. | 6g偏二甲肼含有1.2NA个偏二甲肼分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
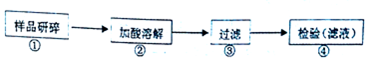
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯水中加入Na2CO3粉末有气体产生 | |
| B. | 用强光照射装满次氯酸的试管(倒置于水槽中)可收集到两种气体 | |
| C. | 漂白粉和次氯酸溶液都是混合物 | |
| D. | 向漂白粉中加入浓盐酸可能产生黄绿色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
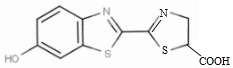
| A. | 荧光素由碳、氢、氧、氮、硫五种元素组成 | |
| B. | 荧光素的化学式是C11H8O3N2S2 | |
| C. | 荧光素属于芳香族化合物 | |
| D. | 荧光素分子中含有羟基、羧基和碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10℃20 mL 3 moL•L-1的X溶液 | B. | 10℃10 mL 2 moL•L-1的X溶液 | ||
| C. | 20℃10 mL 5 moL•L-1的X溶液 | D. | 20℃30 mL 2 moL•L-1的X溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能全部通过滤纸 | B. | 有丁达尔效应 | ||
| C. | 纳米材料能通过半透膜 | D. | 有电泳现象 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com