
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源:2015-2016学年四川省高一上期末模拟化学试卷(解析版) 题型:填空题
电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。用FeCl3溶液做腐蚀液与Cu反应生成CuCl2和FeCl2。
(1)写出该反应的化学方程式 。
(2)印刷电路的废腐蚀液含有大量CuCl2、FeCl2、FeCl3,任意排放会造成环境污染及资源的浪费。通过下列流程可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。
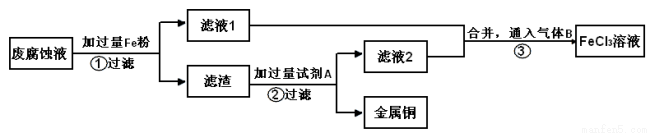 学科Ⅰ、步骤②需加入的试剂A是 (填化学式);
学科Ⅰ、步骤②需加入的试剂A是 (填化学式);
Ⅱ、步骤③通入的气体B是 (填化学式),写出该反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2016届宁夏银川二中高三上学期统考理综化学试卷(解析版) 题型:填空题
用含有Al2O3、SiO2和少量FeO·xFe2O3的铝灰制备Al2(SO4)3·18H2O,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ..再经过一系列操作,分离得到产品。
(1)步骤Ⅰ中过滤所得滤渣主要成分为:______________________,H2SO4溶解Al2O3的离子方程式为:______________________。
(2)步骤Ⅱ中加入KMnO4时发生反应的离子方程式为:_______________________。
(3)已知:生成氢氧化物沉淀的pH
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 3.4 | 6.3 | 1.5 |
完全沉淀时 | 4.7 | 8.3 | 2.8 |
注:金属离子的起始浓度均为0.1 mol·L-1
①根据表中数据解释步骤Ⅱ的目的:__________________________,
②当Al3+开始沉淀时,Fe3+的浓度约为:_______________________。
(4)已知:一定条件下,MnO4-可与Mn2+反应生成MnO2。
①向Ⅲ的沉淀中加入浓盐酸并加热,能说明沉淀中存在MnO2的现象是: 。
②步骤Ⅳ中加入MnSO4的目的是: 。
(5)步骤Ⅴ中“一系列操作”是________________________、________________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高一上学期期中考试化学试卷(解析版) 题型:选择题
下列各组离子在无色酸性溶液中可以大量共存的有
A. Ag+、K+、NO3–、Cl– B.K+、Cu2+、SO42–、HCO3–
C.Mg2+、Cl–、SO42–、Na+ D.CO32–、K+、NO3–、Na+
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省宜春市高一上学期第三次月考化学试卷(解析版) 题型:选择题
下列有关物质制备的反应中,其原理不属于氧化还原反应的是
A.工业制粗硅
B.湿法炼铜
C.用稀盐酸与石灰石反应制取CO2
D.稀硫酸与锌粒反应制取氢气
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高二上学期12月月考化学试卷(解析版) 题型:选择题
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列说法错误的是
A.AgCl不溶于水,不能转化为AgI
B.在含有浓度均为0.001 mol·L-1的Cl-、I-的溶液中缓慢加入AgNO3稀溶液,首先析出AgI沉淀
C.AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于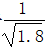 ×10-11mol·L-1
×10-11mol·L-1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高二上学期12月月考化学试卷(解析版) 题型:选择题
下列现象与氢键有关的是
①HF的熔、沸点比ⅦA族其他元素氢化物的高, ②乙醇可以和水以任意比互溶, ③冰的密度比液态水的密度小, ④水分子高温下也很稳定, ⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
A.②③④⑤ B.①②③④ C.①②③⑤ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高一上学期12月月考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数,下列说法正确的是
A.S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA
B.将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积约为22.4L
C.在反应KClO4+8HCl=KCl+4Cl2↑+4H2O中,每生成4molCl2转移的电子数为8NA
D.100ml1mol/LAlCl3溶液中含的阳离子数为0.1NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省桐乡市高二上期中(实验班)化学试卷(解析版) 题型:选择题
下列属于正 确的电离方程式是
确的电离方程式是
A.HCO3- + H2O  CO32- + H3O+ B.NH4+ + H2O
CO32- + H3O+ B.NH4+ + H2O  NH3·H2O + H+
NH3·H2O + H+
C.NaHCO3 Na+ + HCO3- D.H2S
Na+ + HCO3- D.H2S  2H+ + S2-
2H+ + S2-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com