
分析 (1)根据混合溶液的氢离子浓度计算;
(2)先根据混合溶液的氢氧根离子浓度,再结合离子积常数计算氢离子浓度,根据溶液pH的公式计算;
(3)强碱溶液稀释10倍是溶液的pH减小1,注意碱稀释时不能变为酸;
(4)pH=12的NaOH和pH=4的HCl等体积混合后,碱过量,应先计算混合后溶液中氢氧根的浓度,然后根据水的离子积来计算溶液中氢离子浓度,据此分析.
解答 解:(1)设两种酸的体积都是1L,pH=3的盐酸与pH=5的硫酸等体积混合后,混合溶液中氢离子浓度=$\frac{1{0}^{-3}+1{0}^{-5}}{2}$=5.05×10-4 mol/L,则混合溶液的pH=-lg5.05×10-4=3.3,
故答案为:3.3;
(2)设两种碱的体积都是1L,pH=10和pH=12的两种NaOH溶液等体积混合后,混合溶液中氢氧根离子浓度=$\frac{1{0}^{-2}+1{0}^{-4}}{2}$mol/L=5.05×10-3 mol/L,则混合溶液中氢离子浓度=$\frac{1{0}^{-14}}{5.05×1{0}^{-3}}$mol/L=2×10-12mol/L,pH=11.7,
故答案为:11.7;
(3)强碱溶液稀释10倍是溶液的pH减小1,所以pH=9的NaOH溶液稀释到原来的10倍后,pH=8,再稀释到原来的1000倍后,溶液接近中性,则pH≈7,
故答案为:8;≈7;
(4)pH=12的NaOH溶液中氢氧根浓度为0.01mol/L,pH=4的HCl中氢离子浓度为10-4mol/L,等体积混合后,碱过量,混合后溶液中氢氧根的浓度c(OH-)=$\frac{1{0}^{-2}-1{0}^{-4}}{2}$=4.95×10-3mol/L,故氢离子浓度c(H+)=$\frac{1{0}^{-14}}{4.95×1{0}^{-3}}$≈2×10-11mol/L,故pH=11.7,故答案为:11.7.
点评 本题考查了溶液pH的计算,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
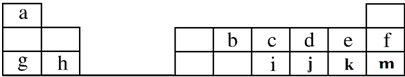
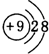 ,元素d与元素g形成的原子个数比为1:1的化合物的电子式为
,元素d与元素g形成的原子个数比为1:1的化合物的电子式为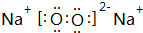 ;(用元素符号填空)
;(用元素符号填空)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质熔沸点的高低顺序是:晶体硅>氯化钠>干冰>汞 | |
| B. | 分子晶体中一定存在分子间作用力 | |
| C. | 水是一种非常稳定的化合物,这是由于氢键所致 | |
| D. | CO2、HCl、CF4、PCl3四种物质分子中的所有原子都满足最外层为8电子的稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO4>H3PO4>H2SiO3 | B. | 还原性:Na>Mg>Al | ||
| C. | 稳定性:HF>HCl>HBr | D. | 原子半径:Cl>S>O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
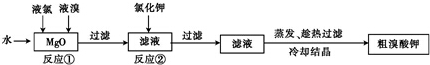
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1L 0.1mol•L-1NaClO溶液中阴离子总数大于0.1NA | |
| B. | 0.5 mol•L-1 CuCl2溶液中含有的Cu2+个数小于0.5NA | |
| C. | 标准状况下,H2和CO混合气体8.96L在足量O2中充分燃烧消耗O2分子数为0.2NA | |
| D. | 在反应4Cl2+8NaOH═6NaCl+NaClO+NaClO3+4H2O中,消耗1mol Cl2时转移电子数为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的气化、液化、干馏以及石油的分馏、裂化、裂解均属化学变化 | |
| B. | 煤燃烧时加入适量石灰石,可形成石膏,从而减少废气中SO2的含量 | |
| C. | 为防止电池中的重金属等污染土壤和水体,应积极开展废电池的回收利用 | |
| D. | 用秸秆发酵产生沼气,作家庭燃气,符合低碳经济的要求 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com