
| A. | NA个D2O分子中,含有10NA个电子 | |
| B. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3molI2转移的电子数为6NA | |
| C. | 1.2g金刚石与石墨的混合物这含有碳碳单键的数目为0.4NA | |
| D. | 1molCl2与足量铁反应转移的电子数目为3NA |
分析 A.D2O分子中含有10个电子;
B.该反应中,生成3molI2 时,1molKIO3的I的化合价从+5价变为了0价,结合化合价变化分析;
C.金刚石是正四面体结构,平均每个碳原子有两个碳碳键,石墨是六边形结构,每个环有两个碳原子,三个碳碳键,平均每个碳原子有1.5个碳碳键;
D.1mol氯气与铁反应最多得到2mol电子.
解答 解:A.NA个D2O分子中含有10mol电子,含有10NA个电子,故A正确;
B.反应KIO3+6HI=KI+3I2+3H2O中,生成3molI2 时,1molKIO3的I的化合价从+5价变为了0价,6molHI中有5molHI的I的化合价从-1价变为了0价,因此生成3molI2转移电子数为5mol,转移的电子数为5NA,故B错误;
C.石墨与金刚石结构不同,相同物质的量碳碳碳键数目不同,只知道混合物总质量无法计算碳碳键数目,故C错误;
D.1molCl2与足量铁反应,最多得到2mol电子,转移的电子数目为2NA,故D错误;
故选A.
点评 本题考查阿伏伽德罗常数的综合应用,题目难度不大,明确物质的量与其它物理量之间的关系即可解答,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
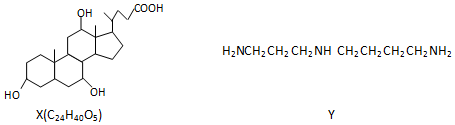
| A. | 1molX在浓硫酸作用下发生消去反应,最多生成3molH2O | |
| B. | 1molY发生类似酯化的反应,最多消耗2molX | |
| C. | X与足量HBr反应,所得有机物的分子式为C24H37O2Br3 | |
| D. | Y与癸烷的分子链均呈锯齿形,但Y的极性较强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为△H=-890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | CO(g)的燃烧热是283.0 kJ•mol-1,则CO2分解的热化学方程式为:2CO2(g)═2CO(g)+O2(g)△H=+283.0 kJ•mol-1 | |
| C. | 一定条件下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| D. | 同温同压下,反应H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )| 选项 | W | X |
| A | 盐酸 | Na2CO3溶液 |
| B | NaOH溶液 | AlCl3溶液 |
| C | CO2 | Ca(OH)2溶液 |
| D | Cl2 | Fe |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加c(CO),平衡向正向移动,反应的平衡常数增大 | |
| B. | 第二阶段,Ni(CO)4分解率较低 | |
| C. | 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃ | |
| D. | 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com