


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
| 操作 | 现象 | 结论 | |
| 步骤一 | 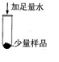 |
固体部分溶解 固体部分溶解 |
猜想二成立 |
| 步骤二 | 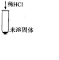 |
固体溶解,产生气泡 固体溶解,产生气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
为使航天员得到一个稳定的、良好的生存环境,一般在飞船内安装有“金属过氧化处理系统”,即不断地把座舱内的空气通过盛放金属过氧化物(以Na2O2为例)的装置,并把处理后的气体充入座舱内。
(1)写出有关反应的方程式:___________________________, _____________________。
处理后的气体充入座舱时,应注意采取的一项措施是________________________________。
(2)有人认为如用KO2(超氧化钾)代替Na2O2也能达到同样的目的(生成物也相似)并具有优越性。写出超氧化钾与CO2反应的化学方程式:_____________________________。
(3)计算用等质量的Na2O2和KO2分别与CO2反应产生O2的体积比。
(4)计算等物质的量的CO2分别与足量Na2O2、KO2反应生成O2的体积比。
(5)从(3)(4)计算结果中可得出的结论是____________________________________;理由是____________________________________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山西省山大附中高一下学期期末考试化学试卷(带解析) 题型:计算题
(6分)在标准状况下,将11.2L乙烯和乙烷的混合气体缓慢的通入足量的溴水中,充分反应后,溴水的质量增加了5.6g(不考虑物质挥发);
(1)写出有关反应的化学方程式
(2)通过计算确定原气体混合物中乙烯与乙烷气体的物质的量之比和质量比
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com