
运用化学反应原理研究部分单质及其化合物的反应有重要意义.
(1)氨是氮循环过程中的重要物质,是氮肥工业的重要原料.氨的合成是目前普遍使用的人工固氮方法:N
2(g)+3H
2(g)?2NH
3(g).请回答
①已知:H-H键能为436kJ/mol,N-N键能为945kJ/mol,N一H键能为391kJ/mol.由键能计算消耗1molN
2时的△H=
.若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡
移动(填“向左”、“向右”或“不”);
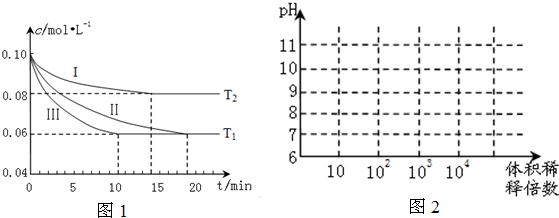
②如图中:当温度由T
1变化到T
2时,K
A
K
B(填“>”、“<”或“=”).
③氨气溶于水得到氨水.在25°C下,将a mol?L
-1的氨水与b mol?L
-1的盐酸等体积混合,反应后溶液中显中性,则c(NH
4+)
c(Cl
-)(填“>”、“<”或“=”);用含a和b的代数式表示出氨水的电离平衡常数表达式
.
(2)硫酸生产中,SO
2催化氧化生成SO
3:SO
2(g)+
O
2(g)?SO
3(g)△H<0,是工业上生产硫酸的关键步骤.
①在某温度时,该反应的平衡常数K=0.75,若在此温度下,向100L的恒容密闭容器中,充入3mol SO
2、4mol O
2和4mol SO
3,则反应开始时正反应速率
逆反应速率(填“<”、“>”或“=”).
②在①中的反应达到平衡后,改变下列条件,能使SO
2(g)平衡浓度比原来减小的是
.
a.保持温度和容器体积不变,充入1.0mol O
2b.保持温度和容器内压强不变,充入2.0mol He
c.降低温度
d.在其他条件不变时,减小容器的容积
③由硫酸可制得硫酸盐.在一定温度下,向K
2SO
4溶液中滴加Na
2CO
3溶液和BaCl
2溶液,当两种沉淀共存时,
=
.[已知该温度时,Ksp(BaSO
4)=1.3×10
-10,Ksp(BaCO
3)=5.2×10
-9].

 运用化学反应原理研究部分单质及其化合物的反应有重要意义.
运用化学反应原理研究部分单质及其化合物的反应有重要意义.

 阅读快车系列答案
阅读快车系列答案

 )是一种化学活性很高的烃,存在于煤焦油中.
)是一种化学活性很高的烃,存在于煤焦油中. 在一定温度下,4L密闭容器内M、N两种物质随时间变化的曲线如图所示:
在一定温度下,4L密闭容器内M、N两种物质随时间变化的曲线如图所示: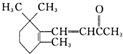 ,关于该有机物的说法正确的是( )
,关于该有机物的说法正确的是( )