
| X | Y |
| Z | W |
| A. | 若HmXOn为强酸,则Y的氢化物溶于水显酸性(m、n均为正整数) | |
| B. | 若W(OH)n为两性氢氧化物,则Z(OH)m为强碱(m、n均为正整数) | |
| C. | 若气体XHn不溶于水,则HmWOn为强酸(m、n、a均为正整数) | |
| D. | 若HmZOn为强酸,则气体HnY易溶于水(m、n、a均为正整数) |
分析 X、Y、Z、W为短周期主族元素,由元素在周期表中的相对位置,可知X、Y处于第二周期,Z、W处于第三周期,
A.若HmXOn为强酸,则X为N元素,Y为O元素,氧元素的氢化物为水;
B.若W(OH)n为两性氢氧化物,则W为Al、Z为Mg,氢氧化镁为弱碱;
C.若气体XHn不溶于水,则X为C、Z为Si、W为P,磷酸为中强酸;
D.若HmZOn为强酸,则X为O、Z为S、Y为F、W为Cl,HF易溶于水.
解答 解:X、Y、Z、W为短周期主族元素,由元素在周期表中的相对位置,可知X、Y处于第二周期,Z、W处于第三周期,
A.若HmXOn为强酸,则X为N元素、Y为O,氧元素的氢化物为水,水为中性,故A错误;
B.若W(OH)n为两性氢氧化物,则W为Al、Z为Mg,氢氧化镁不是强碱,故B错误;
C.若气体XHn不溶于水,则X为C、Z为Si、W为P,磷酸为中强酸,不是强酸,故C错误;
D.若HmZOn为强酸,则X为O、Z为S、Y为F、W为Cl,为HnY为HF,HF易溶于水,故D正确;
故选D.
点评 本题考查位置、结构与性质关系的应用,题目难度中等,试题侧重考查学生发散思维能力,需要学生熟练掌握元素周期表结构、元素周期律内容及元素化合物性质.


科目:高中化学 来源: 题型:选择题
| A. | Zn(l)=Zn(g)△H=$\frac{1}{2}$(△H1-△H2 ) | |
| B. | 用硅制作的太阳能电池是将化学能转化为电能 | |
| C. | 增加Zn(g)的量,△H2变大 | |
| D. | 以Zn片、铜片和稀硫酸构成的原电池,Zn片表面有气泡产生. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃料电池是通过燃烧方式将化学能转换为电能 | |
| B. | 氢氧燃料电池中,通入氢气的一极为正极 | |
| C. | 氢氧燃料电池是一种环境友好电池 | |
| D. | 燃料电池的能量转化率可达100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所得的分散系属于悬浊液 | |
| B. | 所得的分散系中分散质为Fe2O3 | |
| C. | 该分散系能产生丁达尔效应 | |
| D. | 所得分散系为胶体,且胶粒直径即为氢氧化铁分子直径 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氢氟酸在玻璃上镌刻图案:4I++SiO2═H2O+Si4+ | |
| B. | 向Cu2+、Fe3+混合液中加入CuO除去Fe3+;3H2O+3CuO+2Fe3+═2Fe(OH)3+3Cu2+ | |
| C. | 亚硫酸氢钠溶液显酸性:HSO3-═H++SO32- | |
| D. | 用盐酸与碳酸钠反应证明氯的非金属性强与炭:2H++CO32-═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
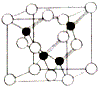 氮、磷、砷是原子序数依次增大的第VA族元素,它们的化合物有着独特的性质和重要用途.
氮、磷、砷是原子序数依次增大的第VA族元素,它们的化合物有着独特的性质和重要用途.| 物质 | 熔点/℃ | 沸点/℃ | 分解温度/℃ |
| NH3 | 195.3 | 239.7 | 107.3 |
| PH3 | 139.2 | 185.4 | 713.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构, 且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
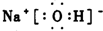 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com