
| A、混合物中Cu的物质的量为0.2 mol |
| B、产生的NO在标准状况下的体积为4.48L |
| C、硝酸的物质的量浓度为2.6mol/L |
| D、Cu?Cu2O与硝酸反应后剩余HNO3为0.2mol |
| 0.6mol |
| 5-2 |
| 1.2mol |
| 0.5L |


科目:高中化学 来源: 题型:
| A、④>③=②>① |
| B、④<③=②<① |
| C、①>②>③>④ |
| D、④>③>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:
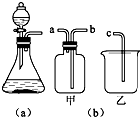 (1)若用上述装置制取O2,除了可选择二氧化锰和
(1)若用上述装置制取O2,除了可选择二氧化锰和查看答案和解析>>
科目:高中化学 来源: 题型:
| 测定序号 | 待测溶液的体积(mL) | 所耗盐酸标准液的体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 1 | 20.00 | 0.50 | 20.78 |
| 2 | 20.00 | 1.20 | 21.32 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | -- | -- | 4.7 | -- |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9 (>9溶解) |
| +6 |
| Cr |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所得混合液中c (Na+)>c (CH3COO-)>c (H+)>c (OH-) |
| B、混合后溶液pH=7 |
| C、混合后溶液中存在c (CH3COOH )+c (CH3COO-)=c (Na+)+c (H+) |
| D、所得混合液中存在c (CH3COOH )+c (CH3COO-)=0.05mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溴苯中的溴(苯) |
| B、溴乙烷中的乙醇(水) |
| C、乙烷中的乙烯(酸性KMnO4溶液) |
| D、苯中的甲苯(溴水) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 0.1032mol/L HCl溶液体积/mL | 待测NaOH溶液体积/mL |
| 1 | 27.83 | 25.00 |
| 2 | 26.53 | 25.00 |
| 3 | 27.85 | 25.00 |
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 1.8×10-10 | 5.0×10-13 | 8.3×10-17 | 2.0×10-48 | 1.8×10-10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com