
【题目】阅读下面的短文,回答问题。
聚碳酸酯(PC)是一类碳酸的聚酯,是一种强韧的热塑性树脂,耐弱酸,耐弱碱,耐中性油,不耐强碱,有阻燃性。其光学性能接近有机玻璃(  ),在透明建筑板材、电子电器、光盘媒介、汽车工业等领域有广泛应用。碳酸本身并不稳定,但其衍生物,如碳酸二苯酚酯、光气等有一定稳定性。工业上以碳酸的衍生物和双酚A为原料合成聚碳酸酯(PC),反应如下:
),在透明建筑板材、电子电器、光盘媒介、汽车工业等领域有广泛应用。碳酸本身并不稳定,但其衍生物,如碳酸二苯酚酯、光气等有一定稳定性。工业上以碳酸的衍生物和双酚A为原料合成聚碳酸酯(PC),反应如下:
(1)下列说法正确的是(填序号)。
a.光气比碳酸稳定
b.聚碳酸酯能和强碱发生反应
c.聚碳酸酯易燃
d.聚碳酸酯是一种强韧的热塑性树脂
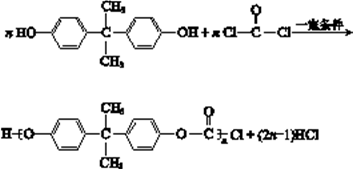
(2)双酚A和光气(  )也可发生类似的缩聚反应,生成一种聚碳酸酯。该反应的化学方程式是。
)也可发生类似的缩聚反应,生成一种聚碳酸酯。该反应的化学方程式是。
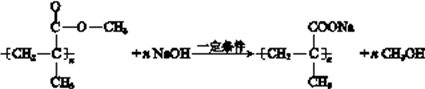
(3)有机玻璃的单体的结构简式是。在一定条件下,有机玻璃和NaOH溶液能发生反应,该反应的化学方程式是。
【答案】
(1)abd
(2)
(3)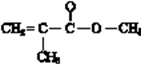 ,
,
【解析】(1)聚碳酸酯是一种强韧的热塑性树脂,不耐强碱,有阻燃性。碳酸本身并不稳定,但其衍生物,如碳酸二苯酚酯、光气等有一定稳定性。由这些信息分析可知a、b、d是正确的。
(2)双酚A和光气( ![]() )发生缩聚反应,生成目标产物和氯化氢小分子,故化学方程式为:
)发生缩聚反应,生成目标产物和氯化氢小分子,故化学方程式为:  ;
;
(3)有机玻璃结构简式: 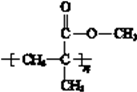 ,它是加聚产物,寻找加聚产物的单体方法是弯箭头法,如
,它是加聚产物,寻找加聚产物的单体方法是弯箭头法,如 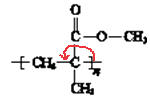 ,单键变双键,双键变单键,则其单体为
,单键变双键,双键变单键,则其单体为 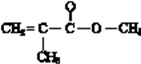 ;
;  在碱性条件下发生酯的水解,生成羧酸盐和醇,化学方程式为:
在碱性条件下发生酯的水解,生成羧酸盐和醇,化学方程式为: 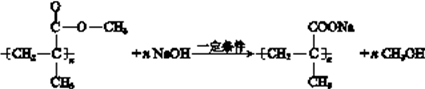 。
。
(1)根据题目叙述中聚碳酸酯的性质进行判断;
(2)双酚A和光气发生缩聚反应,生成目标产物和氯化氢小分子,据此书写化学方程式;
(3)根据酯的水解反应书写水解方程式.


科目:高中化学 来源: 题型:
【题目】通常人们把拆开1 mol某化学键吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以估计化学反应的反应热。下列是一些化学键的键能。
化学键 | C—H | C—F | H—F | F—F |
键能/(kJ·mol | 414 | 489 | 565 | 155 |
根据键能数据估算反应CH4+4F2=CF4+4HF每消耗1mol CH4的热效应( )
A. 放热1940 kJ B. 吸热1940 kJ C. 放热485 kJ D. 吸热485 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2000年诺贝尔化学奖授予两位美国化学家和一位日本化学家,以表彰他们在导电塑料领域的贡献,他们首先把聚乙炔树脂制成导电塑料。下列关于聚乙炔叙述错误的是( )
A. 聚乙炔是以乙炔为单体发生加聚反应形成的高聚物
B. 聚乙炔的化学式为![]() ,分子中所有碳原子在同一直线上
,分子中所有碳原子在同一直线上
C. 聚乙炔是一种碳原子之间以单双键交替结合的链状结构的物质
D. 聚乙炔树脂自身不导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车发动机在工作时,由于电喷,在气缸中会发生反应:N2(g)+O2(g)=2NO(g)。已知该反应过程中的能量变化如图所示,下列说法中错误的是( )
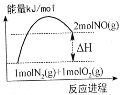
A. 该反应过程中有共价键的断裂和形成
B. 该反应是氧化还原反应
C. 该反应是放热反应
D. 使用催化剂可以改变反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷、乙烯和苯属于不同类型的有机化合物,但它们之间也有共性。下列关于它们之间共同特点的说法正确的有
A. 都由C和H两种元素组成 B. 都能使酸性KMnO4溶液褪色
C. 都能发生加成反应和取代反应 D. 在氧气中完全燃烧后都生成CO2和H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种正投入生产的大型蓄电系统。放电前,被膜隔开的电解质为Na2S2和NaBr3,放电后分别变为Na2S4和NaBr。下列叙述正确的是

A. 放电时,负极反应为3NaBr-2e-==NaBr3+2Na+
B. 充电时,阳极反应为2Na2S2-2e-== Na2S4+2Na+
C. 放电时,Na+经过离子交换膜,由b池移向a池
D. 用该电池电解饱和食盐水,产生2.24LH2时,b池生成17.40g Na2S4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镍具有较高的经济价值。工业上采用一定方法处理含镍废水使其达标排放并回收镍。某电镀废水中的镍主要以NiRz络合物形式存在,在水溶液中存在以下平衡: NiR2(aq) ![]() Ni2+(aq) +2R-(aq) (R-为有机物配体,K=1.6×10-14)
Ni2+(aq) +2R-(aq) (R-为有机物配体,K=1.6×10-14)
(1)传统的“硫化物沉淀法”是向废水中加入Na2S,使其中的NiR2 生成NiS 沉淀进而回收镍。
①该反应的离子方程式为_______________。
②NiS 沉淀生成的同时会有少量Ni(OH)2沉淀生成,用离子方程式解释Ni(OH)2生成的原因是______________。
(2)“硫化物沉淀法”镍的回收率不高,处理后废水中的镍含量难以达标。“铁脱络-化学沉淀法”可达到预期效果,该法将镍转化为Ni(OH)2固体进而回收镍。工艺流程如下:

“脱络”(指镍元素由络合物NiR2转化成游离的Ni3+) 过程中,R-与中间产物-OH (羟基自由基) 反应生成难以与Ni2+络合的-R (有机物自由基),但-OH也能与H2O2发生反应。反应的方程式如下:Fe2+ + H2O2 = Fe3+ +OH-+-OH i
R- +-OH =OH-+-R ii
H2O2+2-OH=O2↑+ 2H2O iii
实验测得“脱络”过程中H2O2的加入量对溶液中镍去除率的影响如图所示:

①从平衡移动的角度解释加入Fe2+和H2O2能够实现“脱络”的原因是______________。
②分析图中曲线,可推断过氧化氢的最佳加入量为_______________ g/ L; 低于或高于这个值,废水处理效果都下降,原因是____________。
(3) 工业上还可用电解法制取三氧化二镍。①用NaOH溶液调节NiCl2溶液PH至7.5,加入适量硫酸钠后采用情性电极进行电解。电解过程中产生的Cl2有80%在弱碱性条件下生成ClO-,再把二价镍氧化为三价镍。写出ClO- 氧化Ni (OH) 2生成三氧化二镍的离子方程式是______, amol二价镍全部转化为三价镍时,外电路中通过电子的物质的量是_________。
②电解法制取三氧化二镍实际过程中,有时获得一种结晶水合物,已知1mol 该物质中含有0.5mol结晶水。取该化合物20.2g进行充分加热,而获得三氧化二镍固体和0.2mol水,则该结晶水合物的化学式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物其结构简式如图,关于该有机物,下列叙述不正确的是( )
A.能使酸性KMnO4溶液、溴水褪色,原理相同
B.1 mol该有机物能与H2发生反应,消耗H2 4mol
C.一定条件下,能发生加聚反应
D.该有机物苯环上的一个H被取代,有3种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有原子序数依次增大的 A、B、C、D、E、F 六种短周期元素;A 元素的原子半径是所有元素中原子最小的; C 元素的最高价氧化物对应水化物与其氢化物能生成盐 M;E 与 A 同主族,F 元素原子的最外层电子数比次外层电子数少 2;A、B、C、E、F这五种元素,每﹣种与 D 元素都能形成原子个数比不相同的若干种化合物.请回答:
(1)D 元素在周期表中的位置为 .
(2)可以比较 D 和 F 得电子能力强弱的是(填写编号).
a.比较这两种元素原子半径的大小
b.二者形成的化合物中,D 元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
(3)盐 M 中含有的化学键类型有;并写出其中阳离子的电子式 .
(4)固体氧化物燃料电池(SOFC)以固体氧化物作为电解质.其工作原理如下图所示.
①固体氧化物中的 O2﹣向(填“正”或“负”)极移动.
②电极 b 为电池极
③若A2 作为燃料气,则接触面上发生的反应为 .
④若B2A4作为燃料气,则接触面上发生的反应为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com