
����Ŀ��ijʵ��С������ȡ����ͭ��֤������ͭ�ܼӿ�����صķֽ⣬����������ʵ�飺
��һ����ȡ����ͭ
�ٳ�ȡ2 gCuSO4��5H2O��ϸ�����ձ�����10 mL����ˮ�ܽ⣻
��������CuSO4��Һ����μ���NaOH��Һ��ֱ�����ٲ���������Ȼ�����û����ת�Ƶ���������������ȫ����Ϊ��ɫ��
�۽���������û������ˡ�ϴ�ӣ����ɺ���ϸ���á�
�ش��������⣺
��1������١�������ĥ��������������������__________________��
��2���������ϴ�ӳ����IJ�����____________________________________��
������֤������ͭ�ܼӿ�����صķֽⲢ��������̵Ĵ�Ч�����бȽ���ͼװ�ý���ʵ�飬ʵ��ʱ��������25 mL����Ϊ����������Ӱ��ʵ������ؾ��Ѻ��ԣ�������ݼ��±���

ʵ����� | KClO3���� | ������������ | �������� |
�� | 1.2g | ���������� | |
�� | 1.2g | CuO 0.5g | |
�� | 1.2g | MnO2 0.5g |
�ش��������⣺
��3������ʵ���еġ��������ݡ�ָ__________________��
��4����Ҫ֤��ʵ����и�������ռ���������O2���ɴ������ռ��������õ��ɼм�סB���齺�ܣ���ȥ������ϵ�����Ƥ����____________________________________��
��5��Ϊ̽��CuO��ʵ������Ƿ�������ã��貹������ʵ�飨����д�������������a��_________________________________��b��CuO�Ļ�ѧ������û�иı䡣
���𰸡��в����������ڹ������У�������ˮ��û����������ˮ��Ȼ���£��ظ�����2-3�β���25mL��������ʱ���������ǵ�Сľ������ľ����ȼ��֤����������ռ���������O2��Ӧǰ������ͭ�������Ƿ�ı�
��������
��ʵ�鲽���֪������ͭ��������ˮ�������м���NaOH��Һ��ת��Ϊ��ɫ��������ͭ���������Ⱥ�������ͭ�ֽ�Ϊ����ͭ�����ˡ�ϴ�ӡ���������ϸ��õ�����ͭ��ĩ����ĥ����ͨ�����в����öԱ�ʵ��Ϳ��Ʊ������о�����ͭ�Ĵ�Ч���������ڷ�Ӧǰ���������䡢��ѧ���ʲ��䡣
��1���������������ĥ���������������������в���
��2���������ϴ�ӳ����IJ����������������ڹ������У�������ˮ��û����������ˮ��Ȼ���£��ظ�����2-3����
��������3�����ݿ��Ʊ�������֪������ʵ���е�������������ָ���Dz���25mL��������ʱ����
��4����Ҫ֤��ʵ����и�������ռ���������O2���ɴ������ռ��������õ��ɼм�סB���齺�ܣ���ȥ������ϵ�����Ƥ������������ǵ�Сľ������ľ����ȼ��֤����������ռ���������O2��
��5��Ϊ̽��CuO��ʵ������Ƿ�������ã��貹������ʵ�飺a����Ӧǰ������ͭ�������Ƿ�ı���b��CuO�Ļ�ѧ������û�иı䡣


 �ƸԹھ��ο���ϵ�д�
�ƸԹھ��ο���ϵ�д� ������ҵ��ͬ����ϰ��ϵ�д�
������ҵ��ͬ����ϰ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܽ�����ת���ɻ�ѧ�ܵ����� ��
A. ˮ������ B. ��ƿ������ C. �ֻ���� D. ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܵĴ�С���Ժ�����ѧ����ǿ����Ҳ�����ڹ��㻯ѧ��Ӧ�ķ�Ӧ�ȣ���H���������о���һЩ��ѧ���ļ������ݣ�������ʹ��
��ѧ�� | Si��O | Si��Cl | H��H | H��Cl | Si��Si | Si��C |
����/kJ��mol��1 | 460 | 360 | 436 | 431 | 176 | 347 |
��ҵ�ϵĸߴ����ͨ�����з�Ӧ��ȡ��SiCl4��g��+2H2��g��Si��s��+4HCl��g�����÷�Ӧ���淴Ӧ�ġ�HΪ ( )
A. ��236 kJmol��1 B. ��412 kJmol��1 C. +236 kJmol��1 D. +412 kJmol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧʵ���Ҳ����ķ�Һ�к���Fe3+��Cu2+��Ba2+��Cl���������ӣ���������з����Է�Һ���д������Ի��ս������Ʊ��Ȼ������Ȼ������壮 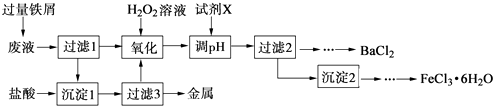
��1������1�к��еĽ��������� ��
��2������ʱ����H2O2��Һ������Ӧ�����ӷ���ʽΪ ��
��3�����������У�������Ϊ�Լ�X����������ĸ����
A.BaCl2
B.BaCO3
C.NaOH
D.Ba��OH��2
��4���������2ϴ���Ƿ���ȫ�ķ����� ��
��5���Ʊ��Ȼ�������������豣�������������Ŀ���� ��
��6���ɹ���2�õ�����Һ�Ʊ�BaCl2��ʵ���������Ϊ����ȴ�ᾧ����ϴ�ӡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С���û�����FeS2���������ƺ�������Һ��Ϸ�Ӧ�Ʊ�ClO2���壬����ˮ���ո�����ɵ�ClO2��Һ���ڴ˹�������Ҫ�������˵��¶ȣ����¶Ȳ���������Ӧ���ӣ�Ӱ������ ClO2����Ĵ��ȣ��һ�Ӱ��ClO2�������ʣ����������ͼ��ʾ��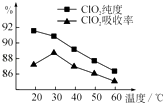
��1����ͼ��֪����Ӧʱ��Ҫ���Ƶ������¶����棬Ҫ�ﵽ��Ҫ����Ҫ��ȡ�Ĵ�ʩ�� ��
��2����֪���������е���Ԫ�������������¿ɱ�ClO3��������SO42�� �� ��д���Ʊ��������ȣ�ClO2�������ӷ���ʽ�� ��
��3����У��ѧѧϰС�����ԡ� ![]() ����Ϊ����ClO2���ʵ�ָ�꣮��ȡNaClO3��Ʒ6.0g��ͨ����Ӧ�����ջ��400mL ClO2��Һ��ȡ����Һ20mL��37.00mL 0.500molL��1 ��NH4��2Fe��SO4��2��Һ��ַ�Ӧ������Fe2+����0.050 0molL��1K2Cr2O7����Һ�ζ����յ㣬����K2Cr2O7����Һ20.00mL����Ӧԭ��Ϊ�� 4H++ClO2+5Fe2+�TCl��+5Fe3++2H2O
����Ϊ����ClO2���ʵ�ָ�꣮��ȡNaClO3��Ʒ6.0g��ͨ����Ӧ�����ջ��400mL ClO2��Һ��ȡ����Һ20mL��37.00mL 0.500molL��1 ��NH4��2Fe��SO4��2��Һ��ַ�Ӧ������Fe2+����0.050 0molL��1K2Cr2O7����Һ�ζ����յ㣬����K2Cr2O7����Һ20.00mL����Ӧԭ��Ϊ�� 4H++ClO2+5Fe2+�TCl��+5Fe3++2H2O
14H++Cr2O72��+6Fe2+�T2Cr3++6Fe3++7H2O
�Լ���ClO2�ġ����ʡ���д��������̣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������![]() �����Ƹ�Ѫѹ��ҩ�������������м��壬һ�ֺϳ�
�����Ƹ�Ѫѹ��ҩ�������������м��壬һ�ֺϳ�![]() ��·�����£�
��·�����£�

��֪������Ϣ��
��![]() �ĺ˴Ź�������Ϊ���壻
�ĺ˴Ź�������Ϊ���壻 ![]() �ĺ˴Ź�������Ϊ����壬�������Ϊ
�ĺ˴Ź�������Ϊ����壬�������Ϊ![]() ��
��
��![]() �ı����Ͻ������ֲ�ͬ��ѧ�������⣻
�ı����Ͻ������ֲ�ͬ��ѧ�������⣻ ![]() ����
����![]() ��
��![]() ��Ӧ��
��Ӧ��
�ش��������⣺
��1��![]() �Ľṹ��ʽΪ______________________��
�Ľṹ��ʽΪ______________________��
��2��![]() �Ļ�ѧ����Ϊ_______________________��
�Ļ�ѧ����Ϊ_______________________��
��3��![]() ��
��![]() ��Ӧ����
��Ӧ����![]() �Ļ�ѧ����ʽΪ______________________________��
�Ļ�ѧ����ʽΪ______________________________��
��4����![]() ����
����![]() �ķ�Ӧ����Ϊ_________________________________��
�ķ�Ӧ����Ϊ_________________________________��
��5��![]() �ķ���ʽΪ______________________________________��
�ķ���ʽΪ______________________________________��
��6��![]() ��
��![]() ��ͬ���칹�壬����
��ͬ���칹�壬����![]() ��Һ������ɫ��Ӧ��
��Һ������ɫ��Ӧ�� ![]() ��
��![]() ����
����![]() ��
��![]() ��Ӧ��
��Ӧ�� ![]() ����________�֣����к˴Ź�������Ϊ����壬�������Ϊ
����________�֣����к˴Ź�������Ϊ����壬�������Ϊ![]() �Ľṹ��ʽΪ________��________��
�Ľṹ��ʽΪ________��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧʷ��ÿһ���ش��ֶ�������ƽ��˿�ѧ�ķ�չ���Ž��з�Ի�ѧ�Ĺ������ڣ� ��
A.��ȡ����űҩ��������
B.�����˺ϳɰ�����������
C.��ʾ��ȼ�յı���
D.�����Ԫ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͨ���û���Ӧ�õ�����������
A. Na��FeSO4��Һ���»�� B. COͨ�����ȵ�Fe2O3
C. H2ͨ��FeSO4��Һ D. Al��Fe3O4��ϼ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ƶ���ػ������ڻ�����ҽҩ�����ϵ��������Ź㷺��Ӧ�á��ش���������:
��1����̬Caԭ����,�������ռ������ܲ�ķ�����________�����ܲ�Ϊ�����ʱ���������ɵĵ�����Ϊ_________��Ԫ��Ca��S���,��һ�����ܽϴ����______(��Ԫ�ط���)��
��2����Ԫ�ص���ɫ��Ӧ��ש��ɫ,���к�ɫ��Ӧ�ķ������Ԫ�ص���ɫ��Ӧ��Ӧ��ɫ�ķ��䲨��,�϶̵���_______(��Ԫ�ط���)��
��3��H2S��H2O���ӹ��Ͷ�ΪV��,����ԭ�ӵ��ӻ���ʽ����______,��H2O���Ӽ��Ǵ���H2S����,ԭ����________________��
��4����Ԫ�غ���Ԫ������ͬһ���ڣ��Һ����������ӹ�����ͬ,�������Ƶ��۵㡢�е�ȶ��Ƚ����̵�,ԭ����________________��
��5��Ca��Mn��Mg������������ﶼ����NaCl�ͽṹ�����Ӿ��������������Ӳ��������������ܶѻ���ʽ,X��������ʵ�������ǵľ����������±�:
�����ᄃ�� | CaO | MnO | MgO |
a/nm | 0.421 | 0.444 | 0.480 |
���ᄃ�� | MgS | MnS | CaS |
a/nm | 0.520 | 0.520 | 0.568 |
�ɱ���֪:r(S2-)____r(O2-)(����>������<��),r(Mg2+)��r(Ca2+)��r(Mn2+)�ɴ�С�ĵ�˳����__________,r(S2-)Ϊ_____nm,r(Ca2+)Ϊ_____nm��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com