
【题目】类推思维是化学解题中常用的一种思维方法,下列有关反应方程式(或离子方程式)的类推正确的是( )
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中: Fe + Cu2+ = Cu + Fe2+ | 将Na加入到CuSO4溶液中: 2Na + Cu2+ = Cu + 2Na+ |
B | 稀硫酸与Ba(OH)2溶液反应至溶液呈中性: 2H++SO42﹣+Ba2++2OH﹣=BaSO4↓+2H2O | NaHSO4溶液与Ba(OH)2溶液反应呈中性: 2H++SO42﹣+Ba++2OH﹣=BaSO4↓+2H2O |
C | 铁和氯气反应2Fe+3Cl2 | 铁和单质反应2Fe+3I2 |
D | 向Ca(ClO)2溶液中通入少量CO2: Ca2++2ClO﹣+CO2+H2O=CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2: Ca2++2ClO﹣+SO2+H2O=CaSO3↓+2HClO |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,在高温下易被空气氧化成CuO。某工厂以硫化铜矿石(含 CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
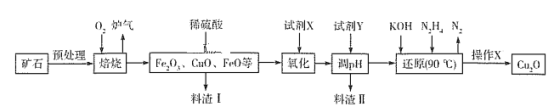
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表

(1)焙烧过程中产生的炉气是一种能造成酸雨有害气体,其化学式是___________,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为___________。
(2)若试剂X是H2O2溶液,其目的是为了将Fe2+离子变成Fe3+,写出相应反应的离子方程式___。当试剂X是___________时,更有利于降低生产成本。
(3)调pH时,加入的试剂Y可以为_______,pH的调控范围是________________。
(4)操作X包括________、洗涤、烘干等一系列操作,其中烘干时要隔绝空气,其目的是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.0.5molFe在O2中燃烧失去的电子数为1.5NA
B.8.7gMnO2与40mL10mol·L-1的浓盐酸充分反应,生成的氯气分子数为0.1NA
C.1molC2H4中所含共用电子对数为6NA
D.1L0.5mol·L-1KHCO3溶液中,阴阳离子总数为1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:Cl2+2HBr=Br2+2HCl。当有0.2molHCl(g)生成时放出8.1kJ的热量。
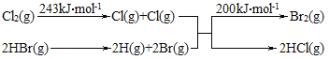
其能量变化示意图如图:请回答:
(1)该反应的热化学方程式是_____。
(2)由上述数据判断断开1molH-Cl键与断开1molH-Br键所需能量相差约为_____kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图10 的是
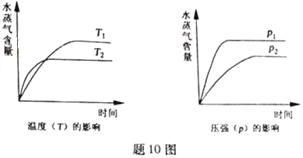
A. CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g);△H<0
CO(NH2)2(s)+H2O(g);△H<0
B. CO2(g)+H2(g)![]() CO(g)+H2O(g);△H>0
CO(g)+H2O(g);△H>0
C. CH3CH2OH (g)![]() CH2=CH2(g)+H2O(g);△H>0
CH2=CH2(g)+H2O(g);△H>0
D. 2C6H5CH2CH3(g)+O2(g)![]() 2 C6H5CH=CH2(g)+2H2O(g);△H<0
2 C6H5CH=CH2(g)+2H2O(g);△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下反应N2+3H2![]() 2NH3 △H<0达平衡,当单独改变下述条件后有关叙述一定错误的是
2NH3 △H<0达平衡,当单独改变下述条件后有关叙述一定错误的是
A. 加催化剂,v(正)和v(逆)都发生变化,且变化的倍数相等
B. 增加c(N2)瞬间,v(正)和v(逆)都增大,且v(正)增加倍数大于v(逆)增加倍数
C. 降温,v(正)和v(逆)都减少,且v(正)减少倍数小于v(逆)减少倍数
D. 加压,v(正)和v(逆)都增大,且v(正)增加倍数大于v(逆)增加倍数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第Ⅷ族元素![]() 、
、![]() 、
、![]() 性质相似,称为铁系元素,主要用于制造合金。回答下列问题:
性质相似,称为铁系元素,主要用于制造合金。回答下列问题:
(1)基态![]() 原子核外能量最高的电子位于_______能级,同周期元素中,基态原子未成对电子数与
原子核外能量最高的电子位于_______能级,同周期元素中,基态原子未成对电子数与![]() 相同的元素名称为______________。
相同的元素名称为______________。
(2)![]() 与酚类物质的显色反应常用于其离子检验,已知
与酚类物质的显色反应常用于其离子检验,已知![]() 遇邻苯二酚(
遇邻苯二酚(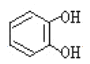 )和对苯二酚(
)和对苯二酚(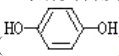 )均显绿色。邻苯二酚的熔沸点比对苯二酚_____(填“高”或“低”),原因是_________。
)均显绿色。邻苯二酚的熔沸点比对苯二酚_____(填“高”或“低”),原因是_________。
(3)有历史记载的第一个配合物是![]() (普鲁士蓝),该配合物的内界为__________。表为
(普鲁士蓝),该配合物的内界为__________。表为![]() 、
、![]() 不同配位数时对应的晶体场稳定化能(可衡量形成配合物时,总能量的降低)。由表可知,
不同配位数时对应的晶体场稳定化能(可衡量形成配合物时,总能量的降低)。由表可知,![]() 比较稳定的配离子配位数是__________(填“4”或“6”)。
比较稳定的配离子配位数是__________(填“4”或“6”)。![]() 性质活泼,易被还原,但
性质活泼,易被还原,但![]() 很稳定,可能的原因是________________。
很稳定,可能的原因是________________。
离子 | 配位数 | 晶体场稳定化能(Dq) |
| 6 | -8Dq+2p |
4 | -5.34Dq+2p | |
| 6 | -12Dq+3p |
4 | -3.56Dq+3p |
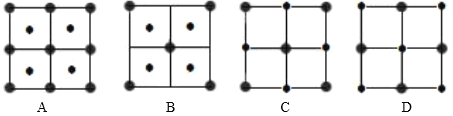
(4)![]() 晶体结构中阴阳离子的配位数均为6,则晶胞的俯视图可能是_______(填选项字母)。若晶胞参数为apm,阿伏加德罗常数的值为
晶体结构中阴阳离子的配位数均为6,则晶胞的俯视图可能是_______(填选项字母)。若晶胞参数为apm,阿伏加德罗常数的值为![]() ,晶体的密度是________
,晶体的密度是________![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g![]() 2NH3(g)ΔH<0。
2NH3(g)ΔH<0。
(1)当反应达到平衡时,N2和H2的浓度比是___;N2和H2的转化率比是____。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量___,密度___(填“变大”、“变小”或“不变”)。
(3)当达到平衡时,充入氮气,并保持体积不变,平衡将____(填“正向”、“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将_____(填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度_____(填“大于”、“小于”或“等于”)原来的2倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于价层电子对互斥模型(VSEPR模型)和杂化轨道理论的叙述中正确的是
A. 凡是中心原子采取sp2杂化的分子,其分子构型都是平面三角形
B. 对于主族元素,中心原子的杂化轨道数等于价层电子对数
C. 杂化轨道可用于形成![]() 键、π键或用于容纳未参与成键的弧电子对
键、π键或用于容纳未参与成键的弧电子对
D. Sp3杂化轨道是由任意的1个s轨道和3个p轨道杂化形成的四个sp3杂化轨道
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com