
����Ŀ��ijѧϰС�鰴����ʵ������̽�������е⺬���IJⶨ�͵����ȡ��
ʵ�飨һ�� �⺬���IJⶨ
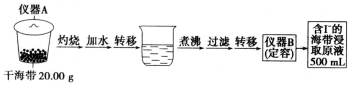
ȡ0.0100 mol��L-1��AgNO3����Һװ��ζ��ܣ�ȡ100.00 mL������ȡԭҺ����ƿ�У���2��3��ָʾ�����ﵽ�յ�ʱ�����ı���Һ�����ƽ��ֵΪ20.00 mL��
��1������A������Ϊ �����ζ���ϴ����δ�ñ���Һ��ϴ������������ȷ�������ĺ������� ���ƫ�ߡ�����ƫ�͡�����Ӱ�족����
��2������ú����е�İٷֺ���Ϊ %��
ʵ�飨���� �����ȡ
��ȡ������ȡԭҺ���ס�������ʵ�鷽�����£�
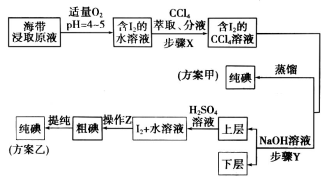
��֪��3I2��6NaOH��5NaI��NaIO3��3H2O�����������£�I2��ˮ��Һ�е��ܽ�Ⱥ�С��
��3������X�У���ȡ���Һ©���ڹ۲쵽�������� ��
��4�������йز���Y��˵������ȷ���� ��
A��Ӧ����NaOH��Һ��Ũ�Ⱥ����
B������ת�������ӽ���ˮ��
C����Ҫ�dz���ȡԭҺ�е��л�����
D��NaOH��Һ�����Ҵ�����
��5��ʵ�飨�����в���Z�������� ��
��6������������������������� ��
���𰸡���1������ ��1�֣� ƫ�� ��1�֣�
��2��0.635 ��2�֣�
��3��Һ��ֲ㣬�ϲ㼸����ɫ���²���Ϻ�ɫ ��2�֣�
��4��AB ��2�֣�
��5������ ��2�֣�
��6���������������µ����ʧ ��2�֣�
��������
�����������1����������A�������ص�ȷ��������Ϊ���������ζ���ϴ����δ�ñ���Һ��ϴ���ὫAgNO3����Һϡ�ͣ��������Һ�����ƫ�������ĺ�������ƫ����
��2�����ݹ�ϵʽ��Ag������I������500mL��I������Һ��I�������ʵ���Ϊ5��0.0100 mol��L-1��0.02L=0.001mol������Ϊ0.001mol��127g/mol=0.127g���������е�İٷֺ���Ϊ0.127g/20g��100%=0.635%��
��3��I2��ˮ�е��ܽ�Ȳ���������CCl4���л��ܼ�����Һ���Ϻ�ɫ��CCl4������ˮ���ܶȱ�ˮ����ȡ���Һ©���ڹ۲쵽��������Һ��ֲ㣬�ϲ㼸����ɫ���²���Ϻ�ɫ��
��4�����������Ϣ֪��I2��CCl4��Һ�м�NaOH��Һ��I2��NaOH��Һ��Ӧ����NaI��NaIO3��ת�������ӽ���ˮ�㣬Ϊ��֤I2ȫ����Ӧ�ͺ�����Ӧ����������Һ�������Ӧ����NaOH��Һ��Ũ�Ⱥ������ѡAB��
��5���������������£�I2��ˮ��Һ�е��ܽ�Ⱥ�С����ʵ�飨�����в���Z�Ƿ���I2�������Һ�IJ�����������������
��6���������в����������������ǵ������������µ����ʧ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����仯�����ڿ��м������о�������Ҫ��Ӧ�á�
��1������P(s)��Cl2 (g)������Ӧ����PCl3(g)�� PCl5(g)����Ӧ�������¡�
2P(s) + 3Cl2(g) = 2PCl3(g) ��H=��612kJ/mol
2P(s) + 5Cl2(g) = 2PCl5(g) ��H=��798kJ/mol
��̬PCl5������̬PCl3��Cl2���Ȼ�ѧ����ʽΪ ��
��2�����淴ӦPCl3(g)+Cl2(g)![]() PCl5(g) 2E(g)
PCl5(g) 2E(g)![]() F(g)+G(g)�ֱ����ܱ�������������Ӧ���н��У���Ӧ��֮���пɻ�������Ħ�����ܷ���塣��Ӧ��ʼ�ʹﵽƽ��ʱ�й��������仯��ͼ��ʾ��
F(g)+G(g)�ֱ����ܱ�������������Ӧ���н��У���Ӧ��֮���пɻ�������Ħ�����ܷ���塣��Ӧ��ʼ�ʹﵽƽ��ʱ�й��������仯��ͼ��ʾ��
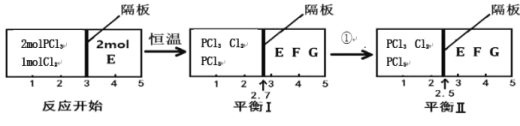
�ٴﵽƽ��Iʱ����ϵѹǿ�뷴Ӧ��ʼʱ��ϵѹǿ֮��Ϊ ��
��ƽ��I��ƽ��II���������� ������¡����¡�����
��3�������ᣨH3PO3����������NaOH��Һ��Ӧ����Na2HPO3�����Na2HPO3��ҺҲ�ɵõ������ᣬװ����ͼ��ʾ��

�����ĵ缫��ӦʽΪ________________����Ʒ���з�Ӧ�����ӷ���ʽΪ ��
��4��һ���¶��£�Ksp [Mg3(PO4)2] =6.0��10-29��Ksp [Ca3(PO4)2] =6.0��10-26����Ũ�Ⱦ�Ϊ0.20 mol��L��1��MgCl2��CaCl2�����Һ����μ���Na3PO4�������� �������ѧʽ�����������Һ����һ�ֽ��������ӳ�����ȫ��Ũ��С��10-5mol/L��ʱ����Һ�е���һ�ֽ��������ӵ����ʵ���Ũ��c= mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪������ͭ��Һ�е��백�������ƣ�H2N��CH2��COONa�����ɵõ������A����ṹ��ͼ1��
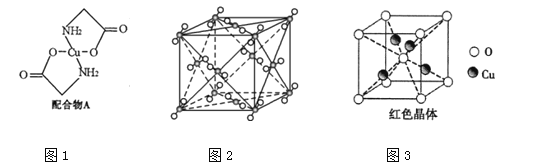
��1��CuԪ�ػ�̬ԭ�ӵ���Χ�����Ų�ʽΪ ��
��2��Ԫ��C��N��O�ĵ�һ�������ɴ�С����˳��Ϊ ��
��3�������A��̼ԭ�ӵĹ���ӻ�����Ϊ ��
��4��1mol���������ƣ�H2N��CH2��COONa�����ЦҼ�����ĿΪ ��
��5�����������Ʒֽ����֮һΪ������̼����ṹ��ͼ2��������________���壬ÿ��CO2������________��CO2���ӽ��ڡ�д��������̼��һ�ֵȵ����壺 ��д��ѧʽ����
��6�� ��֪������ͭ���տ�������һ�ֺ�ɫ���壬��ṹ��ͼ3����û�����Ļ�ѧʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڻ�ѧ��������������,��ȷ����
A. ���ӻ����ﲻ���ܺ����ۼ� B. ���ۻ�������ܺ����Ӽ�
C. ���ӻ�������ֻ�����Ӽ� D. ���ۻ������в������Ӽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й�Ů��ѧ����������Ϊ���������ػ��ŵ����ҽѧ������ͼ�������صĽṹ�����й������ص�˵���в���ȷ����
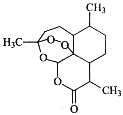
A���С���O������������ʽC15H22O5���ɷ���ȡ����Ӧ
B���С���Ԫ�����ṹ���DZ���ͬϵ��ɷ����ӳɷ�Ӧ
C���С���O��O�������������Խ�ǿ���ɷ�����ԭ��Ӧ
D���С���COO�����������������£��ɷ���ˮ�ⷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
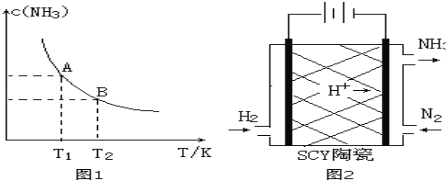
����Ŀ����1����һ�������£���1.00molN2��g����3.00molH2��g�������һ��10.0L�ܱ������У��ڲ�ͬ�¶��´ﵽƽ��ʱNH3��g����ƽ��Ũ����ͼ1��ʾ�������¶�ΪT1ʱƽ���������а������������Ϊ25.0%��
�����¶���T1�仯��T2ʱ��ƽ�ⳣ����ϵK1 K2�����������������=�������ʱ���H 0���������������
���÷�Ӧ��T1�¶���5.00min�ﵽƽ�⣬���ʱ����N2�Ļ�ѧ��Ӧ����Ϊ ��
��T1�¶��¸÷�Ӧ�Ļ�ѧƽ�ⳣ��K1= ��
��2���������¡��˹��̵������о��������ڳ��³�ѹ����������N2�ڴ���������ˮ������Ӧ��2N2��g��+6H2O��l��=4NH3��g��+3O2��g�����˷�Ӧ����S 0�������������������֪��N2��g��+3H2��g��=2NH3��g����H=a kJ/mol 2H2��g��+O2��g��=2H2O��l����H=b kJ/mol 2N2��g��+6H2O��l��=4NH3��g��+3O2��g������H= ���ú�a��b��ʽ�ӱ�ʾ����
��3����ѧ�Ҳ������Ӹߵ����Ե�SCY�մɣ��ɴ���H+��ʵ���˵��³�ѹ�¸�ת���ʵĵ绯ѧ�ϳɰ�����ʵ��ԭ��ʾ��ͼ��ͼ2��ʾ���������ĵ缫��Ӧʽ�� ��
��4����֪ijЩ���������ˮ�еĵ���ƽ�ⳣ����25�������±���
������� | H2CO3 | NH3.H2O |
����ƽ�ⳣ�� | Ka1=4.30��10-7 Ka2=5.61��10-11 | Kb=1.77��10-5 |
���г�����0��1 mol��L-1�ģ�NH4��2CO3��Һ��
������Һ�� �ԣ���ᡱ�����С����������ԭ���� ��
���ã�NH4��2CO3��Һ�и���Ũ��֮��Ĺ�ϵʽ����ȷ���� ��
A��c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3.H2O)
B��c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C��c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol/L
D��c(NH4+)+c(NH3.H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
E��c(H+)+c(HCO3-)+c(H2CO3)=c(OH-)+c(NH3.H2O)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ֻ���й��ۼ����ǣ� ��
A��Na2O2 B��NaCl C��HCl D��NaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£����ݻ�Ϊ2L���ܱ�������ͨ���������巢����ѧ��Ӧ����Ӧ�и����ʵ����ʵ����仯��ͼ��ʾ���Ը÷�Ӧ���ƶϺ�������

A���÷�Ӧ�Ļ�ѧ����ʽΪ3B+2D 6A+4C
B����Ӧ���е�1 sʱ��v��A����3v��D��
C����Ӧ���е�6 sʱ��B��ƽ����Ӧ����Ϊ0.1mol/(Ls)
D����Ӧ���е�6 sʱ�������ʵķ�Ӧ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в����д�����ǣ� ��
A����ȥ���������е����������������Na2CO3��Һ����Һ
B����ȥFe2O3�е�����Al2O3����������NaOH��Һ�����ˣ�ϴ�Ӹ���
C����ȥ�����е������Ȼ�����ͨ��ʢ�б���ʳ��ˮ��Һ��ϴ��ƿ
D����ȡ�ܽ���ˮ�е������⣺�����ƾ��������÷ֲ��ȡ���л����ٷ���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com