
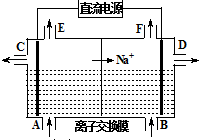
 电解原理在工业生产中有广泛的应用.
电解原理在工业生产中有广泛的应用.
| ||
| ||
| ||


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案科目:高中化学 来源: 题型:
| A、1.0L0.10mol?L-1Ba(OH)2溶液中Ba2+的个数是0.10NA | ||||
B、反应2C+SiO2
| ||||
| C、1mol液态N2O4中分子总数小于NA | ||||
| D、常温下,5.6g 铁钉与足量浓硝酸反应,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Clˉ)>c(NH4+)>c(H+)=c(OHˉ) | ||
| B、在0.1mol?L-1 的NaHA溶液pH=4,则H2A为强酸 | ||
| C、pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊呈红色 | ||
D、向0.1mol?L-1的氨水中加少量硫酸铵固体,则溶液中
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 充电 |
| 放电 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=4的醋酸中:c(H+)=4.0mol?L-1 |
| B、pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol?L-1 |
| C、饱和食盐水中:c(Na+)+c(H+)=c(Cl-)+c(OH-) |
| D、饱和小苏打溶液中:c(Na+)=c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com