
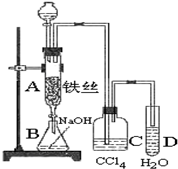
 实验室用图装置制取少量溴苯,试填写下列空白.
实验室用图装置制取少量溴苯,试填写下列空白.分析 由溴苯制备实验装置可知,苯与溴在三溴化铁为催化剂时发生取代反应生成溴苯,反应的化学方程式为 ,B中NaOH吸收溴,与溴苯分层,C中四氯化碳吸收HBr中的溴单质,D中HBr溶于水,与硝酸银反应生成AgBr沉淀,D中导管在液面上,可防止倒吸,以此来解答.
,B中NaOH吸收溴,与溴苯分层,C中四氯化碳吸收HBr中的溴单质,D中HBr溶于水,与硝酸银反应生成AgBr沉淀,D中导管在液面上,可防止倒吸,以此来解答.
解答 解:(1)由图可知,分液漏斗中装的试剂是苯、溴,故答案为:苯;溴;
(2)B中氢氧化钠的作用为吸收溴单质,与溴苯分层,故答案为:吸收溴单质,与溴苯分层;
(3)应完毕后,D中HBr溶于水,向试管D中滴加AgNO3溶液有淡黄色沉淀生成,此现象说明这种获得溴苯的反应属于取代反应,故答案为:淡黄色沉淀;取代反应;
(4)溴易溶于四氯化碳,不易溶于水,则C中盛放的四氯化碳的作用吸收HBr中的溴蒸气,故答案为:吸收HBr中的溴蒸气;
(5)纯溴苯为无色液体,它比水重,故答案为:无;重;
(6)因HBr极易溶于水,则D中导管的下口不能浸没于液面中,否则易发生倒吸,故答案为:不能,导管口在液面下可发生倒吸.
点评 本题考查有机物的制备实验,为高频考点,把握制备原理、有机物的性质、混合物分离提纯为解答的关键,侧重分析与实验能力的考查,注意有机反应及混合物分离提纯的应用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
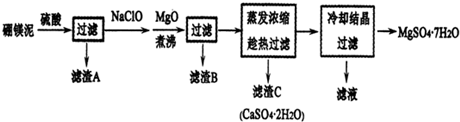
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
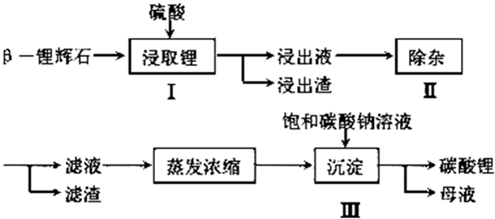
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
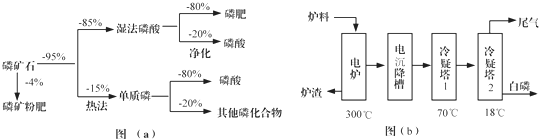
| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水、有还原性 |
| SiF4 | -90 | -86 | 易水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
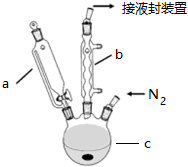
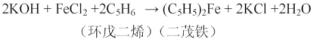
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
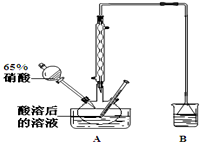 亚硝酸钠可大量用于染料和有机合成工业.
亚硝酸钠可大量用于染料和有机合成工业.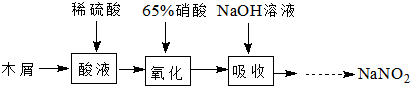
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
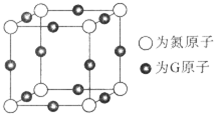 A、B、C、D、E、F、G是前四周期(除稀有气体)原子序数依次增大的七种元素,A的原子核外电子只有一种运动状态;B、C的价电子层中未成对电子数都 是2;B、C、D同周期;E核外的s、p能级的电子总数相;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满.回答下列问题:(相关问题用元素符号表示)
A、B、C、D、E、F、G是前四周期(除稀有气体)原子序数依次增大的七种元素,A的原子核外电子只有一种运动状态;B、C的价电子层中未成对电子数都 是2;B、C、D同周期;E核外的s、p能级的电子总数相;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满.回答下列问题:(相关问题用元素符号表示)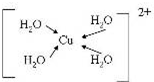 (配位键用→标出).
(配位键用→标出).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com