
| A. | ①②③ | B. | ①②④ | C. | ①③ | D. | ③④ |
分析 ①相对分子质量=$\frac{1个分子质量}{1{个}^{12}C原子质量×\frac{1}{12}}$;
②摩尔质量以g/mol作单位,在数值上等于其相对原子质量;
③该氧分子的摩尔质量为mNAg•mol-1,根据n=$\frac{m}{M}$计算ag该氧气分子的物质的量;
④氧气不一定处于标况下.
解答 解:①氧气分子的质量为mg,则氧气分子相对分子质量为$\frac{mg}{ng×\frac{1}{12}}$=$\frac{12m}{n}$,故①正确;
②氧气分子的质量为mg,则NA 各个氧气分子质量为mNAg,该氧气分子的摩尔质量mNAg/mol,故②错误;
③该氧分子的摩尔质量为mNAg•mol-1,ag该氧气分子的物质的量为$\frac{ag}{m{N}_{A}g/mol}$=$\frac{a}{m{N}_{A}}$mol,故③正确;
④a g该氧气分子的物质的量为$\frac{a}{m{N}_{A}}$mol,但氧气所处状态下气体摩尔体积不一定为22.4L/mol,故④错误,
故选:C.
点评 本题考查相对分子质量、摩尔质量、物质的量有关计算等,注意对相对分子质量与摩尔质量的理解,掌握常用的计算方法,为易错题.


 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:选择题
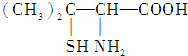
| A. | 青霉氨基酸分子中所有碳原子均在同一直线上 | |
| B. | 青霉氨基酸具有两性并能发生酯化反应 | |
| C. | 青霉氨基酸分子间不能发生缩合反应 | |
| D. | 1 mol青霉氨基酸与足量的金属钠反应生成0.5 mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c1 | 0.2 | pH=7 |
| 丙 | 0.1 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2用作呼吸面具的供氧剂 | B. | 工业上电解熔融状态Al2O3制备Al | ||
| C. | 工业上利用合成氨实现人工固氮 | D. | 实验室用NH4Cl 和Ca(OH)2制备NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com