
【题目】如下图所示,烧杯中都盛有稀硫酸。

(1)①中反应的离子方程式为________。
(2)②中的电极反应:Fe极:_____、Cu极:_____,Cu极附近溶液的pH____(填增大、减小或不变)。
(3)③中作负极的金属是____,其电极反应式为_______。比较①、②、③中纯铁被腐蚀的速率由快到慢的顺序______(用序号回答)。
【答案】 Fe + 2H+ =Fe2+ + H2↑ Fe + 2e- =Fe2+ 2H+ + 2e-=H2↑ 增大 Zn(锌) Zn-2e-=Zn2+ ②>①>③
【解析】(1)①中铁和稀硫酸直接发生氧化还原反应生成硫酸亚铁和氢气,反应的离子方程式为Fe+2H+=Fe2++H2↑;(2)②中构成原电池,铁的金属性强于铜,铁是负极,电极反应式为Fe+2e-=Fe2+,铜是正极,溶液中的氢离子放电,电极反应式为2H++2e-=H2↑,氢离子浓度减小,所以Cu极附近溶液的pH增大;(3)③中构成原电池,锌的金属性强于铁,作负极的金属是锌,其电极反应式为Zn-2e-=Zn2+;根据以上分析可知①、②、③中纯铁被腐蚀的速率由快到慢的顺序为②>①>③。


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
【题目】在某2 L恒容密闭容器中充入2 mol X(g)和1 mol Y(g)发生反应:2X(g)+Y(g)![]() 3Z(g),反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )
3Z(g),反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )

A. M点时,Y的转化率最大
B. 升高温度,平衡常数减小
C. 平衡后充入Z,达到新平衡时Z的体积分数增大
D. W、M两点Y的正反应速率相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要使工业废水中的重金属Pb2+沉淀,可用硫酸盐、碳酸盐、硫化物等作沉淀剂,已知Pb2+与这些离子形成的化合物的溶解度如下:
化合物 | PbSO4 | PbCO3 | PbS |
溶解度/g | 1.03×10-4 | 1.81×10-7 | 1.84×10-14 |
由上述数据可知,选用沉淀剂最好为( )
A. 硫化物 B. 硫酸盐
C. 碳酸盐 D. 以上沉淀剂均可
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁原子电池放电时电压高而平稳,电池反应为xMg+Mo3S4![]() MgxMo3S4,下列说法错误的是( )
MgxMo3S4,下列说法错误的是( )
A. 放电时负极反应为Mg-2e-===Mg2+
B. 放电时Mg2+向正极区移动
C. 充电时阳极反应为Mo3S4+xMg2++2xe-===MgxMo3S4
D. 充电时电池的负极接充电电源的负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2 L的密闭容器中进行如下反应:A(g)+2B(g)![]() 3C(g)+2D(g),开始时A为4 mol,B为6 mol;5 min末时测得C的物质的量为3 mol。请计算:
3C(g)+2D(g),开始时A为4 mol,B为6 mol;5 min末时测得C的物质的量为3 mol。请计算:
(1)5min末A的物质的量浓度___________________;
(2)5min内D的平均化学反应速率____________________;
(3)B的转化率_____________________________;
(4)反应后容器中的总压强与反应前总压强之比为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组同学拟分析某市空气的质量情况,测定该市空气中SO2的含量并制定下列研究方案:
Ⅰ.资料表明,SO2具有较强的还原性,能与高锰酸钾酸性溶液发生反应:5SO2+2![]() +2H2O===5
+2H2O===5![]() +2Mn2++4H+。
+2Mn2++4H+。
Ⅱ.设计实验方案:利用SO2的还原性使SO2和已知浓度及体积的高锰酸钾酸性溶液反应。
Ⅲ.选择分析地点:某工业区、某公园、某居民小区、某商业区、某交通枢纽。
Ⅳ.选择分析时间:晴天、风速较小时;晴天、风速较大时;雨前;雨后。
Ⅴ.对测定的结果进行初步分析并向相关单位提出建议。
(1)该小组同学拟用如图所示装置定量分析空气中SO2的含量。
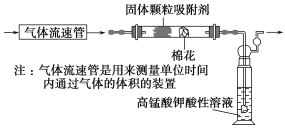
①通入空气前应进行的实验操作是________________________________;
②当观察到实验的现象为________________________________________时,应停止通空气;
③实验过程中需测量并记录的数据是_________________________________。
(2)如图表示该小组同学根据实验测得的该市不同地区空气中SO2的含量。
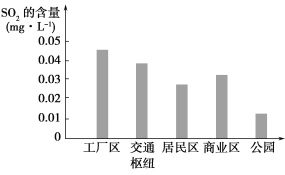
①工厂区、交通枢纽SO2含量明显高于其他地区的原因是_____________;
②请向当地有关部门提出一条减少工厂区SO2排放的建议:__________________________。
(3)下表是该小组同学测得的不同天气情况下的城市空气中SO2的平均含量。请分析雨后或风速较大时SO2平均含量较低的原因:
天气情况 | 平均风速(m·s1) | 空气中SO2的平均含量(mg·L1) |
雨前 | 2.0 | 0.03 |
雨后 | 2.2 | 0.01 |
晴 | 23 | 0.015 |
晴 | 0.9 | 0.03 |
①_____________________________________________________;
②_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77kJ·mol-1
CH3OH(g) △H3=-90.77kJ·mol-1
回答下列问题:
(1)反应Ⅱ的△H2=______________。
(2)反应Ⅲ能够自发进行的条件是______________(填“较低温度”、“ 较高温度”或“任何温度”)。
(3)恒温,恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是________。
A.混合气体的密度不再变化
B.混合气体的平均相对分子质量不再变化
C.CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1
D.甲醇的百分含量不再变化
(4)对于反应Ⅰ,不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是____。

A.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1
B.温度低于250℃时,随温度升高甲醇的产率增大
C.M点时平衡常数比N点时平衡常数大
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(5)若在1L密闭容器中充入3molH2和1molCO2发生反应Ⅰ,则图中M点时,产物甲醇的体积分数为_____;该温度下,反应的平衡常数K=__________;若要进一步提高甲醇积分数。可采取的措施有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是______(填字母序号)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
(2)硫酸渣的主要化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。用该废渣制取药用辅料——红氧化铁的工艺流程如下(部分操作和条件略):
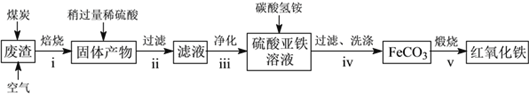
回答下列问题:
①在步骤i中产生的有毒气体可能有__________________。
②在步骤iii操作中,要除去的离子之一为Al3+。若常温时Ksp[Al(OH)3]=1.0×10-32,此时理论上将Al3+沉淀完全,则溶液的pH为____________。
③步骤iv中,生成FeCO3的离子方程式是_________________。
(3)氯化铁溶液称为化学试剂中的“多面手”,向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生新的沉淀,写出该沉淀的化学式_________________。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释:___________________。
(4)①古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应ii的离子方程式是________________。
②如今基于普鲁士蓝合成原理可检测食品中CN-,方案如下:
![]()
若试纸变蓝则证明食品中含有CN-,请解释检测时试纸中FeSO4的作用:
_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com