
 苯甲醛(
苯甲醛(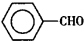 )、苯甲酸(
)、苯甲酸(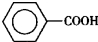 )都是重要的化工原料,都可用甲苯(
)都是重要的化工原料,都可用甲苯(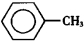 )为原料生产.下表列出了有关物质的部分物理性质,请回答:
)为原料生产.下表列出了有关物质的部分物理性质,请回答:| 名称 | 性状 | 熔点(℃) | 沸点(℃) | 相对密度 ρ水=1g/cm3 | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
| 苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
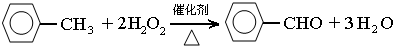 .
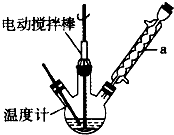
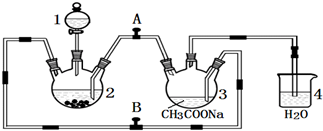
.分析 (1)由仪器a结构可知为球形冷凝管,甲苯挥发会导致产率降低;三颈瓶中甲苯被过氧化氢氧化生成苯甲醛,同时还生成水;
(2)但温度过高时过氧化氢分解,实际参加反应的过氧化氢质量减小;
(3)反应完毕后,反应混合液经过自然冷却至室温时,先过滤分离固体催化剂,再利用蒸馏的方法分离出苯甲酸;
(4)实验中加入过量的过氧化氢并延长反应时间时,会使苯甲醛产品中产生较多的苯甲酸.
①先与碳酸氢钠反应之后为苯甲酸钠,再分液分离,水层中加入盐酸得到苯甲酸晶体,最后过滤分离得到苯甲酸;
②苯甲酸的物质的量等于消耗KOH物质的量,再计算产品中苯甲酸的质量分数;
a.滴定时俯视读取耗碱量,会使KOH溶液体积读数偏小;
b.碱式滴定管用蒸馏水洗净后即盛装KOH标准液,导致消耗氢氧化钾溶液体积偏大;
c.配置KOH标准液时仰视定容,液面在刻度线上方,配制标准液的体积偏大、浓度偏小,导致滴定时消耗KOH溶液体积偏大;
d.将酚酞指示剂换为甲基橙溶液,终点时溶液呈酸性,消耗氢氧化钾溶液体积偏小.
解答 解:(1)由仪器a结构可知为球形冷凝管,甲苯挥发会导致产率降低,冷凝回流,防止甲苯挥发导致产率降低;
三颈瓶中甲苯被过氧化氢氧化生成苯甲醛,同时还生成水,反应方程式为: ,
,
故答案为:冷凝回流,防止甲苯挥发导致产率降低; ;
;
(2)但温度过高时过氧化氢分解速度加快,实际参加反应的过氧化氢质量减小,苯甲醛的产量却有所减少,
故答案为:温度过高时过氧化氢分解速度加快,实际参加反应的过氧化氢质量减小,影响产量;
(3)反应完毕后,反应混合液经过自然冷却至室温时,先过滤分离固体催化剂,再利用蒸馏的方法分离出苯甲酸,
故答案为:过滤、蒸馏;
(4)实验中加入过量的过氧化氢并延长反应时间时,会使苯甲醛产品中产生较多的苯甲酸.
①先与碳酸氢钠反应之后为苯甲酸钠,再分液分离,水层中加入盐酸得到苯甲酸晶体,最后过滤分离得到苯甲酸,再洗涤、干燥得到苯甲酸,故正确的操作步骤是:dacb,
故答案为:dacb;
②若对实验①中获得的苯甲酸产品进行纯度测定,可称取2.500g产品,溶于100mL乙醇配成溶液,量取所得的乙醇溶液10.00mL于锥形瓶,滴加2~3滴酚酞指示剂,然后用预先配好的0.1000mo/L KOH标准液滴定,到达滴定终点时消耗KOH溶液20.00mL.
苯甲酸的物质的量等于消耗KOH物质的量,则2.500g产品中苯甲酸为0.020L×0.1mol/L×$\frac{100ml}{10ml}$×122g/mol=2.44g,产品中苯甲酸的质量分数为$\frac{2.44g}{2.500g}$×100%=97.60%;
a.滴定时俯视读取耗碱量,会使KOH溶液体积读数偏小,计算苯甲酸的质量偏小,测定结果偏低,故a符合;
b.碱式滴定管用蒸馏水洗净后即盛装KOH标准液,导致消耗氢氧化钾溶液体积偏大,测定结果偏高,故b不符合;
c.配置KOH标准液时仰视定容,液面在刻度线上方,配制标准液的体积偏大、浓度偏小,导致滴定时消耗KOH溶液体积偏大,测定结果偏高,故c不符合;
d.将酚酞指示剂换为甲基橙溶液,终点时溶液呈酸性,消耗氢氧化钾溶液体积偏小,测定结果偏低,故d符合,
故答案为:97.60%;ad.
点评 本题考查有机物合成实验、物质的分离提纯、实验方案设计、对操作的分析评价、物质含量测定等,较好的考查学生对数据的应用、阅读获取信息的能力以及知识迁移应用,难度中等.


科目:高中化学 来源: 题型:解答题
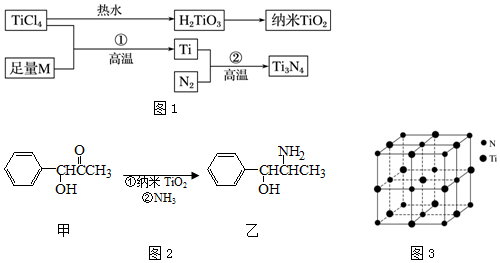
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/kJ•mol-1 | 738 | 1451 | 7733 | 10540 | 13630 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
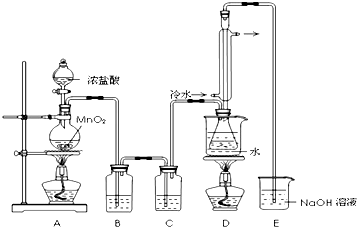
| 物质 | 沸点/℃ | 熔点/℃ |
| S | 445 | 113 |
| CS2 | 47 | -109 |
| CCl4 | 77 | -23 |
| S2Cl2 | 137 | -77 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
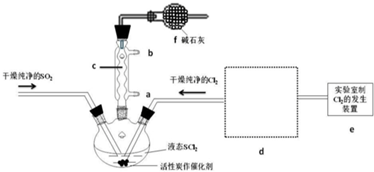
| 方案 | 甲 | 乙 | 丙 | 丁 |
| 发生装置 |  |  | 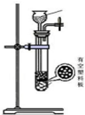 | 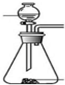 |
| 所选试剂 | NaHSO3固体 | 18.4mol/LH2SO4+Cu | 4mol/LHNO3+Na2SO3 | 70%H2SO4+K2SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
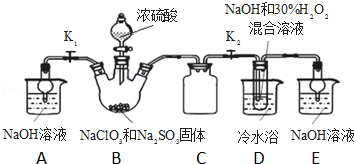
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol NO的质量是30g | |
| B. | 标准状况下,1 mol H2O的体积是22.4 L | |
| C. | 17 g NH3含有的氢原子总数为6.02×1023 | |
| D. | 0.1 mol Na2CO3中,Na+的物质的量为 0.1 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com