
| A. | 蒸馏时沸石的作用是防止液体受热时突然沸腾(爆沸) | |
| B. | 蒸馏操作时,需要将温度计水银球插入到蒸馏液体的液面以下 | |
| C. | 用蒸发方法使NaCl从溶液中析出时,应加热至蒸发皿中溶液全部蒸干 | |
| D. | 用浓硫酸配制稀硫酸时,可将量取好的浓硫酸直接转移至容量瓶后再加水定容 |
分析 A.液体加热通常加热沸石防止暴沸;
B.温度计测量的是蒸汽的温度,应该放在蒸馏烧瓶的支管口处;
C.溶液蒸发结晶剩余液体利用余热蒸干;
D.稀释浓硫酸应该在烧杯中进行,不能直接在容量瓶中稀释浓硫酸.
解答 解:A.液体加热通常加热沸石以防止液体受热时突然沸腾,故A正确;
B.蒸馏操作中,温度计测量的是蒸汽的温度,温度计水银球应在蒸馏烧瓶支管口处,故B错误;
C.用蒸发方法使NaCl从溶液中析出时,蒸发时待蒸发皿中出现较多量固体时停止加热,若水分全部蒸干,固体会受热不均向外迸溅,所以利用余热蒸干,故C错误;
D.稀释浓硫酸应该在烧杯中进行,如果浓硫酸直接转移至容量瓶后再加水定容,浓硫酸稀释放出大量的热,冷却到室温导致溶液体积偏小,所配溶液浓度偏大,且容量瓶受热不均,可能导致容量瓶破裂,故D错误;
故选A.
点评 本题考查化学实验方案的评价,题目难度不大,涉及浓硫酸的稀释操作、溶液配制、蒸发、蒸馏等知识,明确常见化学实验基本操作方法为解答关键,试题侧重考查学生的分析能力及化学实验能力.


 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:选择题
| A. | 向NaAlO2溶液中加入适量的稀硫酸后,蒸干并灼烧 | |
| B. | 向NaAlO2溶液中通入过量的CO2后,过滤并灼烧 | |
| C. | 向AlCl3溶液中加入适量的NaAlO2溶液后,蒸干并灼烧 | |
| D. | 向AlCl3溶液中加入过量的NaOH溶液后,过滤并灼烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 加入试剂 | 稀硫酸 | 浓硫酸、加热 | 稀硝酸 | 浓硝酸 |
| 实验现象 | 红色固体和蓝色溶液 | 无色气体和蓝色溶液 | 无色气体和蓝色溶液 | 红棕色气体和蓝色溶液 |
| A. | Cu | B. | Cu2O | ||
| C. | 一定有Cu,可能有Cu2O | D. | 一定有Cu2O,可能有Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 盐酸 | 水煤气 | 硫酸 | 醋酸 | HD |
| B | 冰醋酸 | 汽油 | 苛性钾 | 碳酸氢钠 | 乙醇 |
| C | 烧碱 | 蔗糖溶液 | 氯化钠 | 氨水 | 三氧化硫 |
| D | 胆矾 | 石灰水 | 硫酸钡 | H2O | NH3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
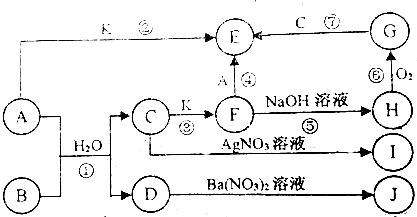
| 实验步骤 | 实验现象 | 用化学用语解释 |
| 将少量气体通入淀粉KI溶液 | 溶液最初变成 蓝 | Cl2+2I-=I2+2Cl- |
| 继续通入气体 | 溶液逐渐变成无色 | 5Cl2+I2+6H2O=2HIO3+10HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
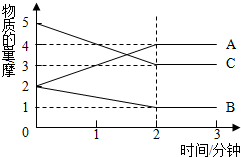 在容积为2升的密闭容器中,进行某可逆反应,反应过程中各物质的量的变化情况如图所示,其中A、B、C都为气体.则该反应的化学方程式为2C+B?2A.
在容积为2升的密闭容器中,进行某可逆反应,反应过程中各物质的量的变化情况如图所示,其中A、B、C都为气体.则该反应的化学方程式为2C+B?2A.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
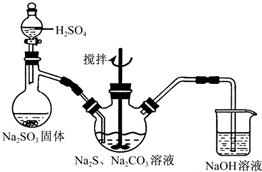 硫代硫酸钠(Na2S2O3)俗称海波,可用于纸浆漂白作脱氯剂等.实验室通过如下反应制取:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2.
硫代硫酸钠(Na2S2O3)俗称海波,可用于纸浆漂白作脱氯剂等.实验室通过如下反应制取:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com