将5.0mol PCl3和2.5mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)?PCl5(g),达到平衡时,PCl5为1mol,如果此时移走2.0mol PCl3和1.0mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
A.<0.6 mol
B.0.6 mol
C.>0.6 mol
D.无法确定
【答案】
分析:5.0mol PCl
3和2.5mol Cl
2充入体积不变的密闭容器中,根据生成PCl
5计算参加反应的 PCl
3的物质的量,进而计算 PCl
3的转化率,平衡时移走2.0mol PCl
3和1.0mol Cl
2,可以相当于开始加入移走3mol PCl
3和1.5mol Cl
2,假定平衡不移动,则PCl
3的转化率不变,计算生成PCl
5的物质的量,实际是压强降低平衡向逆反应移动,实际PCl
3的转化率降低,故实际生成的PCl
5的物质的量小于假设计算值.
解答:解:5.0mol PCl
3和2.5mol Cl
2充入体积不变的密闭容器中,达到平衡时,生成PCl
5为1mol,
由方程式PCl
3(g)+Cl
2(g)?PCl
5(g)可知,参加反应的PCl
3为1mol,PCl
3的转化率为
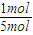
×100%=20%,
平衡时移走2.0mol PCl
3和1.0mol Cl
2,可以相当于开始加入移走3mol PCl
3和1.5mol Cl
2,假定平衡不移动,则参加反应PCl
3的物质的量为3mol×20%=0.6mol,由方程式可知生成PCl
5的物质的量为0.6mol,实际是压强降低平衡向逆反应移动,实际PCl
3的转化率降低,故生成PCl
5的物质的量小于0.6mol,
故A.
点评:本题考查化学平衡的有关计算,难度中等,注意假设法的利用与平衡建立途径的关键.

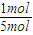 ×100%=20%,
×100%=20%,

 发散思维新课堂系列答案
发散思维新课堂系列答案