


科目:高中化学 来源: 题型:
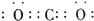
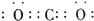
查看答案和解析>>
科目:高中化学 来源: 题型:
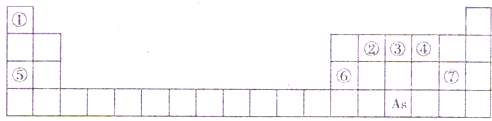
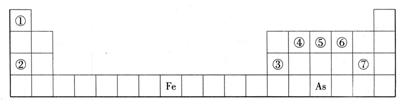
下表是元素周期表的一部分,A、B、C、D、E、X、Y是一表中给出元素组成的常见单质或化合物。
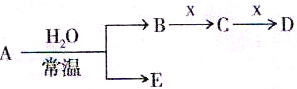
I.已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去)
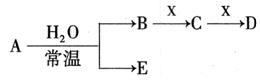
(1)若E为氧化物,则A的化学式为 ,A与水反应的化学方程式为 。
①当X是碱性盐溶液,C分子中有22个电子时,则C的电子式为 ,表示X呈碱性的离子方程式为 。
②当X为金属单质时,X与B的稀溶液反应生成C的离子方程式为 。
(2)若E为单质气体,D为白色沉淀,A的化学式可能是 ,B含有的化学键类型为 ,C与X反应的离子方程式为 。
(3)若B为单质气体,D可与水蒸气在一定条件下发生可逆反应,生成C和一种可燃性气体单质,写出该可逆反应的化学方程式 。t°C时,在密闭恒容的某容器中投入等物质的量的D和水蒸气,一段时间后达到平衡,该温度下反应的平衡常数K=1,D的转化率为 。
II.元素周期是人们研究物质性质的重要工具。
(1)As在周期表中的位置 。
(2)As的原子结构示意图为 ,其氢化物的化学式为 。
(3)Y由②⑥⑦三种元素组成,它的水溶液是一种生活中常见的消毒剂。As可与Y的溶液反应,生成As最高价含氧酸,该反应的化学方程式为 ,当消耗1mol还原剂时,电子转移了 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、D、E、X、Y是原子序数依次增大的短周期主族元素。其中X原子最外层电子数是内层电子总数的3倍;X、Y同族;A与X、Y既不同族也不同周期;D元素的某种同位素原子在考古方面有重要应用。
(1)Y的离子结构示意图为 。
(2)钠、A和X三种元素组成的化合物,其所含的化学键类型有 。
(3)甲由A、E两种元素组成,分子中含有18个电子,只存在共价单键。常温下甲是一种无色液体。
①甲是一种二元弱碱,写出其一级电离方程式: 。
②甲在碱性溶液中能够将CuO还原为Cu2O,已知每1mol甲参加反应有 4 mol电子转移,该反应的化学方程式为: 。
(4)处理含DX、YX2烟道气污染的一种方法,是在催化剂作用下使两者反应,产物之一为单质Y。已知反应生成1 g Y固体单质时放出8.4 kJ热量,此反应的热化学方程式为 。
(5)将0.050 mol YX2(g)和0.030mol X2(g)放入容积为1 L的密闭容器中,反应:
X2(g) +2YX 2(g)2YX3(g)在一定条件下达到平衡。
①若其他条件不变,增大体系的压强,平衡常数K (填“增大”、“减小”或“不变”)。
②平衡时测得c(X2)=0.010mol·Lˉ1。该条件下反应的平衡常数K= ,YX2的平衡转化率为 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年福建省莆田市高三适应性练习(理综)化学部分 题型:填空题
(16分)A、D、E、X、Y是原子序数依次增大的短周期主族元素。其中X原子最外层电子数是内层电子总数的3倍;X、Y同族;A与X、Y既不同族也不同周期;D元素的某种同位素原子在考古方面有重要应用。
(1)Y的离子结构示意图为 。
(2)钠、A和X三种元素组成的化合物,其所含的化学键类型有 。
(3)甲由A、E两种元素组成,分子中含有18个电子,只存在共价单键。常温下甲是一种无色液体。
①甲是一种二元弱碱,写出其一级电离方程式: 。
②甲在碱性溶液中能够将CuO还原为Cu2O,已知每1mol甲参加反应有 4 mol电子转移,该反应的化学方程式为: 。
(4)处理含DX、YX2烟道气污染的一种方法,是在催化剂作用下使两者反应,产物之一为单质Y。已知反应生成1 g Y固体单质时放出8.4 kJ热量,此反应的热化学方程式为 。
(5)将0.050 mol YX2(g)和0.030 mol X2(g)放入容积为1 L的密闭容器中,反应: X2(g) +2YX 2(g)  2YX3(g)在一定条件下达到平衡。
2YX3(g)在一定条件下达到平衡。
①若其他条件不变,增大体系的压强,平衡常数K (填“增大”、“减小”或“不变”)。
②平衡时测得c(X2)=0.010 mol·Lˉ1。该条件下反应的平衡常数K= ,YX2的平衡转化率为 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年福建省高三第二次模拟考试(理综)化学试题 题型:填空题
A、D、E、X、Y是原子序数依次增大的短周期主族元素。其中X原子最外层电子数是内层电子总数的3倍;X、Y同族;A与X、Y既不同族也不同周期;D元素的某种同位素原子在考古方面有重要应用。
(1)Y的离子结构示意图为 。
(2)钠、A和X三种元素组成的化合物,其所含的化学键类型有 。
(3)甲由A、E两种元素组成,分子中含有18个电子,只存在共价单键。常温下甲是一种无色液体。
①甲是一种二元弱碱,写出其一级电离方程式: 。
②甲在碱性溶液中能够将CuO还原为Cu2O,已知每1mol甲参加反应有 4 mol电子转移,该反应的化学方程式为: 。
(4)处理含DX、YX2烟道气污染的一种方法,是在催化剂作用下使两者反应,产物之一为单质Y。已知反应生成1 g Y固体单质时放出8.4 kJ热量,此反应的热化学方程式为 。
(5)将0.050 mol YX2(g)和0.030 mol X2(g)放入容积为1 L的密闭容器中,反应:
X2(g) +2YX 2(g) 2YX3(g)在一定条件下达到平衡。
2YX3(g)在一定条件下达到平衡。
①若其他条件不变,增大体系的压强,平衡常数K (填“增大”、“减小”或“不变”)。
②平衡时测得c(X2)=0.010 mol·Lˉ1。该条件下反应的平衡常数K= ,YX2的平衡转化率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com