
对于密闭容器中的可逆反应:mX(g)+nY(s)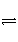
 pZ(g) ΔH<0,达化学平衡后,改变条件,下列表述不正确的是( )
pZ(g) ΔH<0,达化学平衡后,改变条件,下列表述不正确的是( )
A.增大压强,化学平衡不一定发生移动
B.通入氦气,化学平衡不一定发生移动
C.增加X或Y的物质的量,化学平衡一定发生移动
D.其它条件不变,升高温度,化学平衡一定发生移动
科目:高中化学 来源: 题型:
现有M、N、P、E 4种元素的单质,能发生以下反应①在水溶液中,M+N2+===M2++N
②P+2H2O(冷)===P(OH)2+H2↑ ③N、E相连浸入稀H2SO4中,电极反应为:N-2e-===N2+,2H++2e-===H2↑ 判断它们的还原性由强到弱的顺序是 ( )
A.M、N、P、E B.P、M、N、E C.M、N、E、P D.E、P、M、N
查看答案和解析>>
科目:高中化学 来源: 题型:
硫代硫酸钠可作为脱氯剂,已知25.0mL0.100 mol·L-1Na2S2O3溶液恰好把224mL(标准状况下)Cl2完全转化为Cl—离子,则将S2O32-转化成( )
A.S2— B.S C.SO32- D. SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
3 mol H2和1 mol N2放入密闭容器中,使用催化剂发生反应:N2(g)+3H2(g)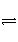
 2NH3(g),从反应开始到平衡过程中,不可能出现的是( )
2NH3(g),从反应开始到平衡过程中,不可能出现的是( )
A.2 mol NH3 B.0.5 mol NH3
C.0.9 mol N2 D.H2和NH3物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
在新制的氯水中存在平衡:Cl2+H2O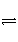
 H++Cl-+HClO,若向氯水中投入少量碳酸钙粉末,溶液中发生的变化是( )
H++Cl-+HClO,若向氯水中投入少量碳酸钙粉末,溶液中发生的变化是( )
A.H+浓度减小,HClO浓度减小
B.H+浓度增大,HClO浓度增大
C.H+浓度减小,HClO浓度增大
D.H+浓度增大,HClO浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中发生下列反应:aA(g)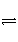
 cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
A.平衡向正反应方向移动 B.a<c+d
C.D的体积分数增大 D.A的转化率变大
查看答案和解析>>
科目:高中化学 来源: 题型:
在某一容积可变的密闭容器中,可逆反应A(g)+B(g)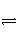
 xC(g) ΔH,符合图象(Ⅰ)所示关系。由此推断,对图象(Ⅱ)的说法不正确的是( )
xC(g) ΔH,符合图象(Ⅰ)所示关系。由此推断,对图象(Ⅱ)的说法不正确的是( )
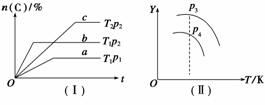
A.p3>p4,Y轴表示A的转化率
B.p3>p4,Y轴表示B的质量分数
C.p3>p4,Y轴表示混合气体的密度
D.p3>p4,Y轴表示混合气体的平均相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,浓度均为0.1mol·L-1的HA溶液和BOH溶液,pH分别是1和11。下列说法正确的是( )
A. 在0.1 mol·L-1 BA溶液中c(A-)+c(H+)=c(BOH) +c(OH-)
B. 若将0.1 mol·L-1 BOH溶液稀释至0.001 mol·L-1则溶液的pH=9
C. 若将一定量的上述两溶液混合后pH=7,则混合液中:c(A-)> c(B+)
D. 若将上述两溶液按体积比1: 2混合,则混合液中: c(B+) > c(A-) > c(BOH) > c(OH-) > c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
钾水玻璃以其优异的性能广泛用于防腐、铸造、油田、钻井或各种高档涂料中。钾水玻璃中硅含量的测定可以采用氟硅酸钾容量法,其步骤为:
①称取试样溶解在含有过量的氟离子和钾离子的强酸溶液中,硅能与氟离子、钾离子作用生成氟硅酸钾(K2SiF6)沉淀;
②沉淀分离后于热水中水解,生成HF、H2SiO3、KF;
③过滤除去硅酸沉淀,用氢氧化钠标准溶液滴定滤液。
(1)上述步骤②中的水解反应方程式为 ;
步骤③中反应的离子方程式为: 。
(2)在步骤③中,若滴定前未用氢氧化钠标准溶液润洗滴定管,则测得的硅元素含量将
(填“偏高”、或“偏低”或“不变”)。
(3)若每次称取试样的质量为1.00g,重复滴定四次,消耗1.00 mol·L-1氢氧化钠标准溶液的体积为分别为16.80mL、19.90mL、20.00mL、20.10mL,试计算该试样中硅元素的质量分数(以二氧化硅计),写出计算过程。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com