
| A. | 若单位时间生成xmolNO的同时,消耗1.5xmolH2O,则反应达到平衡状态 | |
| B. | 达到平衡状态后,NH3、O2、NO、H2O(g)的物质的量之比为4:5:4:6 | |
| C. | 达到平衡状态时,若增加容器体积,则反应速率增大 | |
| D. | 达到平衡时,5v正(O2)=4v逆(NO) |
分析 A.计算消耗的H2O的物质的量,与生成的H2O的物质的量比较判断;
B.到达平衡时,反应混合物的物质的量关系与起始投入量及转化率有关;
C.浓度越大速率越大;
D.可逆反应到达平衡时,不同物质表示的正、逆速率之比等于化学计量数之比.
解答 解:A.单位时间内生成xmolNO的同时也生成1.5xmolH2O,为正反应方向,消耗1.5xmolH2O为逆反应方向,正逆反应速率相同,说明反应达到平衡状态,故A正确;
B.到达平衡时,反应混合物的物质的量关系与起始投入量及转化率有关,达到化学平衡时,NH3、O2、NO、H2O物质的量之比可能为4:5:4:6,也可能不是,故B错误;
C.达到平衡状态时,若增加容器体积,则反应物和生成物的浓度减少,反应速率减慢,故C错误;
D.4v(O2)正=5v(NO)逆,反应为处于平衡状态,5v正(O2)=4v逆(NO)不是平衡状态,故D错误;
故选A.
点评 本题考查化学平衡状态的特征与判断,难度中等,注意理解化学平衡状态,选择判断化学平衡的物理量,应随反应进行发生变化,该物理量由“变化”到“不变化”,说明到达平衡,试题有利于培养学生的分析、理解能力.


科目:高中化学 来源: 题型:选择题
| A. | 邻二甲苯(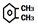 )、邻羟基苯甲醛( )、邻羟基苯甲醛(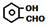 )熔沸点均于其对应对位取代物 )熔沸点均于其对应对位取代物 | |
| B. | 卤素元素的单质及其氢化物的熔沸点随原子半径的增大而升高 | |
| C. | 石墨、金刚石、碳化硅、晶体硅、白磷、水、干冰熔沸点依次降低 | |
| D. | NaCl、MgCl2、MgO、Al2O3熔沸点依次减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 实验步骤 | 实验现象 | 结论 |
| Ⅰ | 在两个蒸发皿中各加入10mL冷水,控制相同燃烧条件,分别用乙醇和汽油作为燃料进行加热,记录从开始到水沸腾的时间. | 用乙醇加热耗时118s;用汽油加热耗时56s. | 猜想2不成立 (填“成立”或“不成立”) |
| Ⅱ | 实验Ⅰ停止加热后,取下蒸发皿,观察蒸发皿的底部. | 用乙醇加热的蒸发皿底部只有及少量炭黑,而用汽油加热的蒸发皿底部有大量的炭黑. | 猜想1成立(可仿照上格填写) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是可逆反应N2(g)+3H2(g)?2NH3(g)在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
如图是可逆反应N2(g)+3H2(g)?2NH3(g)在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )| A. | t1时,只有正反应在不断进行,速率在逐渐减小 | |
| B. | t2时,反应到达限度,在此条件下N2的转化率达到最大 | |
| C. | t2-t3,反应不再发生,各物质的物质的量保持恒定 | |
| D. | t3以后,N2(g)、H2(g)、NH3(g)的物质的量浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
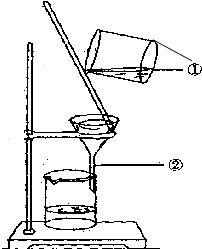 如图为某学生进行粗盐提纯实验中过滤操作的示意图,试回答:
如图为某学生进行粗盐提纯实验中过滤操作的示意图,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
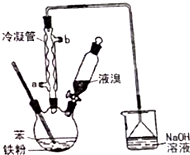 溴苯是一种化工原料,实验室用苯和液溴合成溴苯的装置示意图如图.(夹持仪器已略去)
溴苯是一种化工原料,实验室用苯和液溴合成溴苯的装置示意图如图.(夹持仪器已略去) +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr,反应过程中烧瓶内有白雾产生,是因为生成HBr了气体.
+HBr,反应过程中烧瓶内有白雾产生,是因为生成HBr了气体.| 苯 | 溴苯 | |
| 沸点/℃ | 80 | 156 |
| 水中溶解度 | 微溶 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 硫酸锰铵[(NH4)2SO4•MnSO4•nH2O]是浅粉色晶体,易溶于水,在农业上用作微量元素肥料.实验室由MnO2制备硫酸锰铵的实验步骤如下:
硫酸锰铵[(NH4)2SO4•MnSO4•nH2O]是浅粉色晶体,易溶于水,在农业上用作微量元素肥料.实验室由MnO2制备硫酸锰铵的实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在化学反应过程中,发生物质变化的同时一定发生能量变化 | |
| B. | 破坏生成物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量时,反应为吸热反应 | |
| C. | 反应产物的总焓大于反应物的总焓时,反应吸热,△H>0 | |
| D. | 热化学方程式中反应热数值的大小与化学方程式的计量数成比例 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com